Диоксоланы
Диоксоланы — органическое соединение класса пятичленных гетероциклов, содержащих в кольце 2 атома кислорода. В зависимости от положения атомов кислорода различают 1,2- и 1,3-диоксолан. Наиболее стабильны 1,3-диоксоланы.
| Диоксоланы | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
1,3-диоксолан | ||
| Хим. формула | C3H6O2 | ||
| Физические свойства | |||
| Молярная масса | 74.08 г/моль | ||
| Плотность | 1.06 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -95 °C | ||
| • кипения | 75 °C | ||
| Классификация | |||
| Рег. номер CAS | 646-06-0 | ||
| PubChem | 12586 | ||
| Рег. номер EINECS | 211-463-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 87597 | ||
| ChemSpider | 12066 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
1,3-диоксолан
Химические свойства

1,3-диоксолан легко растворяется в воде, с иодом образует комплекс, с бромом реагирует, образуя 2-бромэтилформиат. С хлором реакция приводит к смеси замещенных по 2-м или 4-м положении.
Применение
- 1,3-диоксолан можно рассматривать как циклический ацеталь формальдегида и этиленгликоля, а замещенные по второму положению 1,3-диоксоланы — как ацетали других альдегидов или кетонов.
Перевод в 1,3-диоксоланы является защитой для альдегидов и кетонов[1] или 1,2-диолов[2], поскольку они устойчивы к действию оснований и устойчивы в нейтральной среде.
 Защита альдегидной группы
Защита альдегидной группы Защита кетогруппы
Защита кетогруппы Защита 1,2-диолов
Защита 1,2-диолов
- Используется в качестве как экстрагента для жиров, масел, восков.
- В качестве низкокипящего растворителя красок и эфиров целлюлозы.
- При перемешивании раствора реагентов в присутствии ортоэфиров как водопоглощающего средства[3].
Методы синтеза
- 1,3-диоксолан получают из формалина и этиленгликоля кипячением в присутствии фосфорной кислоты[4].
- 2-замещённые 1,3-диоксоланы кипячением смеси альдегида и этиленгликоля в бензоле (толуоле, хлороформе, ксилоле, трихлорэтилене, дихлорметане) в присутствии пара-толуолсульфокислоты с азеотропной отгонкой образующейся воды и катализе пара-толуолсульфокислотой.
- обменным способом, когда кетон смешивается с диоксоланом более летучего кетона (ацетон, 2-бутанон и др.). При кипячении в присутствии пара-толуолсульфокислоты происходит обмен и более летучий кетон покидает сферу реакции, смещая равновесие в нужную сторону.
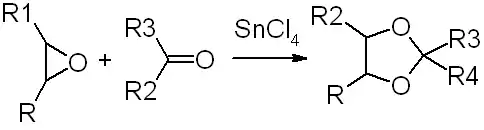
- реакцией этиленоксида с кетонами или альдегидами в присутствии SnCl4
Свойства
1,3-диоксоланы и их производные гидролизуются в кислой среде, образуя соответствующие альдегид и гликоль.
1,2-диоксолан
1,2-диоксоланы и их производные является циклическими пероксидами, и поэтому нестабильны: сам 1,2-диоксолан устойчив только до 35 °C. Его производные легко разлагаются при нагревании и облучении[7]. Их получают по следующим схемам:


Соединения, содержащие структуру 1,2-диоксолана, — промежуточные продукты в биосинтезе эндо-пероксидов простагландинов.
Примечания
- Дж. МакОми. Защитные группы в органической химии. — М.: Мир, 1976. — С. 305—307.
- W. Theilheimer. Synthetic Methods of Organic Chemistry. Interscience Publ. Inc., V 13, 1959, p. 34.
- TETRAHEDRON, 1983, 39, N 6, 991—997.
- И. Губен. Методы органической химии, том 3 выпуск 1. — М.-Л.: ОНТИ, 1934.
- J. AMER. CHEM. SOC., 1982, 104, N 3, 853—855.
- J. CHEM. RES. SYNOP., 1980, NO 18, 95 (M 1163—1173)
- Химическая энциклопедия Т2. — М.: Сов. Энциклопедия, 1990. — С. 74.