Белая жировая ткань
Бе́лая жирова́я ткань — разновидность жировой ткани, адипоциты которой содержат одну крупную жировую каплю, окружённую ободком цитоплазмы с оттеснённым на периферию клеточным ядром. Помимо адипоцитов, в состав белой жировой ткани входят клетки так называемой стромальной васкулярной фракции: преадипоциты, фибробласты, клетки эндотелия сосудов и ряд иммунных клеток, такие как макрофаги жировой ткани[1].
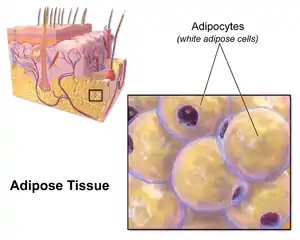
Главная функция белой жировой ткани — запасание липидов, кроме того, она обеспечивает теплоизоляцию тела. Жировая ткань продуцирует ряд гормонов (эстроген, лептин, резистин, а также цитокины, такие как фактор некроза опухоли α) и в последние годы была признана важной частью эндокринной системы. У взрослого человека белая жировая ткань располагается под кожей, вокруг внутренних органов (висцеральная жировая ткань), внутри костей (жёлтый костный мозг), между мышечными волокнами и в молочных железах[1].
Строение
Адипоцит белой жировой ткани, как правило, имеет шарообразную форму и содержит одну большую каплю нейтрального жира (такие адипоциты также называют унилокулярными), которая занимает центральную часть клетки и окружена тонким слоем цитоплазмы, в утолщённой части которого залегает уплощённое ядро. В цитоплазме адипоцитов содержатся в небольших количествах и другие липиды: холестерин, фосфолипиды, а также свободные жирные кислоты. Эти мелкие жировые включения особенно выражены у незрелых адипоцитов. 87 % массы жировой ткани взрослого человека приходится на липиды[2]. В цитоплазме, прилегающей к ядру, а также в противолежащем более тонком слое цитоплазмы присутствуют нитевидные и палочковидные митохондрии с плотно упакованными кристами, редуцированный аппарат Гольджи и несколько цистерн шероховатого эндоплазматического ретикулума и свободные рибосомы. Тонкий субмембранный слой цитоплазмы, окружающий липидную каплю, содержит цистерны гладкого эндоплазматического ретикулума, а также многочисленные пиноцитозные пузырьки[3]. Зрелый адипоцит имеет крупные размеры, от 50 до 150 мкм. Так как липиды вымываются ксиленом и другими растворителями, использующимися при приготовлении гистологических препаратов, унилокулярные адипоциты при рассмотрении с помощью светового микроскопа выглядят пустыми[4].
Рыхлая волокнистая соединительная ткань образует прослойки, которые делят жировую ткань на дольки разного размера и формы. В дольках адипоциты близко прилегают друг к другу, однако в жировой ткани также присутствуют клетки так называемой стромальной васкулярной фракции: преадипоциты, фибробласты, клетки эндотелия сосудов и ряд иммунных клеток, такие как макрофаги жировой ткани[1]. На клетки стромальной васкулярной фракции приходится около половины всех клеток жировой ткани[5]. Жировые клетки разделяются тонкими коллагеновыми волокнами, ориентированными во всех направлениях, а также оплетены ретикулярными волокнами[5]. Группы адипоцитов или отдельные дольки тесно охватываются кровеносными и лимфатическими капиллярами[6].
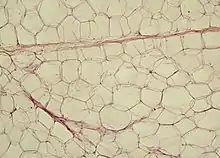
Количество жира в адипоцитах белой жировой ткани, как и их количество, подвергается значительным колебаниям. При усиленном питании могут появляться новые адипоциты из адвентициальных клеток, прилегающих к кровеносным капиллярам. При этом в цитоплазме новообразованных адипоцитов появляются мелкие капли жира, которые, разрастаясь, сливаются в одну жировую каплю. По мере увеличения жировой капли эндоплазматический ретикулум и аппарат Гольджи редуцируются, а ядро сдавливается и уплощается[7]. При голодании околопочечная и подкожная жировая ткань теряют жировые запасы, липидные капли в адипоцитах измельчаются, а сами адипоциты приобретают звёздчатую или веретеновидную форму. Однако вблизи орбиты глаз, на подошвах и ладонях жировая ткань почти не изменяется даже при длительном голодании, так как играет в основном не обменную, а механическую роль. В этих местах она подразделяется на мелкие дольки, окружённые волокнами соединительной ткани[8].
Анатомия
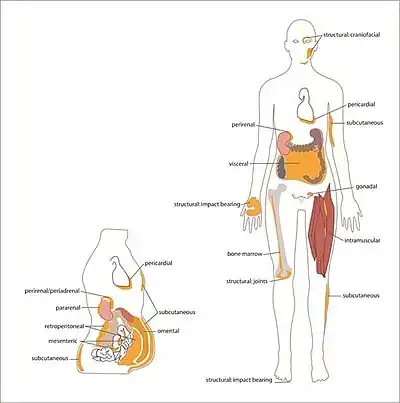
У взрослого человека белая жировая ткань располагается под кожей, особенно в нижней части брюшной стенки, на ягодицах и бёдрах (в составе подкожной ткани), вокруг внутренних органов (висцеральная жировая ткань), внутри костей (жёлтый костный мозг), между мышечными волокнами и в молочных железах. Бурая жировая ткань, выраженная у новорождённых детей и некоторых животных (грызунов и млекопитающих, впадающих в спячку), располагается на шее, около лопаток, за грудиной, вдоль позвоночника, под кожей и между мышцами[9]. У взрослого человека бурая ткань присутствует и метаболически активна[10][11], однако она регрессирует с возрастом[12].
Висцеральный жир, также известный как абдоминальный жир, располагается в брюшной полости между внутренними органами — желудком, печенью, кишечником, почками и другими[13]. Висцеральный жир подразделяется на несколько основных скоплений: мезентерический жир, эпидимальный жир и периренальный жир[14]. Висцеральный жир, расположенный вблизи сердца, называется эпикардиальным. Он продуцирует множество биологически активных веществ, которые могут существенно влиять на работу сердца[15]. Увеличение висцерального жира наиболее выражено у мужчин, в то время как женщины накапливают жир в основном в бёдрах и на ягодицах[16][17].
Большая часть невисцерального жира залегает под кожей в гиподерме и входит в состав подкожной ткани[18]. Подкожная жировая ткань в области ягодиц и бёдер наиболее выражена у женщин. После наступления менопаузы существенная часть жировых отложений в организме женщины переходит в область талии[19], и позднее жир накапливается преимущественно в области живота[20]. Подкожная жировая ткань, помимо метаболической функции, играет механическую роль и выступает как теплоизолирующий слой[21][22]. Хотя морфологически адипоциты висцерального жира и подкожной жировой ткани идентичны, они существенно различаются по профилям экспрессии генов[23].
Жёлтый костный мозг представлен жировыми клетками, перемежающимися с гемопоэтическими клетками и костными элементами. Объём жёлтого костного мозга увеличивается при ограничении калорийности питания и даже при анорексии, что принципиально отличает его от других жировых отложений[24][25][26], однако он увеличивается и при ожирении[27]. Физические упражнения уменьшают объём жёлтого костного мозга и приводят к уменьшению размеров адипоцитов костного мозга[27][28][29]. Адипоциты костного мозга имеют ряд отличий как от адипоцитов белого жира, так и от адипоцитов бурого жира. При рождении большая часть костного мозга приходится на кроветворный красный костный мозг, однако в течение жизни он постепенно преобразуется в жёлтый костный мозг, поэтому объём жёлтого костного мозга растёт с возрастом у обоих полов. Адипоциты костного мозга являются локальным источником энергии. Есть сведения, что жёлтый костный мозг отрицательно влияет на формирование костного материала, и его избыточное увеличение коррелирует с развитием остеопороза и остеопении, однако неизвестно, связан ли этот эффект напрямую с деятельностью адипоцитов или он обусловлен изменениями микросреды костного мозга[30].
Эктопический жир — это хранилище триглицеридов, не относящееся к собственно жировой ткани и накапливающее относительно небольшое количество жира. Эктопический жир присутствует в печени, скелетных мышцах, сердце и поджелудочной железе[31]. Причины, лежащие в основе избыточного накопления эктопического жира, неизвестны. Снижение массы тела также приводит к сокращению эктопических жировых запасов[32].
Физиология
Метаболизм жиров
Жировая ткань играет важную роль в поддержании уровня свободных жирных кислот и триглицеридов в крови, а также вносит вклад в развитие инсулинорезистентности (особенно абдоминальный жир). Адипоциты также могут запасать триглицериды, поступающие с пищей и циркулирующие в крови в составе хиломикронов, липиды, синтезируемые печенью и циркулирующие в кровотоке в виде липопротеинов очень низкой плотности, кроме того, свободные жирные кислоты и глицерин могут синтезироваться в самих адипоцитах. Хиломикроны и липопротеины очень низкой плотности при поступлении в жировую ткань гидролизуются липопротеинлипазой на люминальной поверхности кровеносных капилляров. Свободные жирные кислоты поступают в адипоциты по механизму активного транспорта и диффузии. В адипоцитах жирные кислоты в ходе реакции этерификации присоединяются к глицеринфосфату с образованием триглицеридов, которые поступают в жировую каплю[33].
В жировой ткани идёт постоянное поступление и выход свободных жирных кислот. Результирующее направление движения свободных жирных кислот контролируются гормонами инсулином и лептином. Если инсулин повышен, то вход свободных жирных кислот в жировую ткань превышает её выход, и выход жирных кислот из жировой ткани возможен только при низком уровне инсулина в крови. Уровень инсулина повышается при поступлении в организм углеводной пищи, которое приводит к росту концентрации сахара в крови[34]. Инсулин также стимулирует поглощение глюкозы адипоцитами и способствует её преобразованию в жир[35].
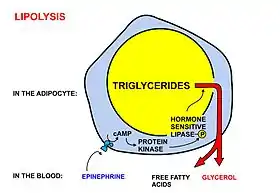
При нервной или гуморальной стимуляции адипоцитов жировые запасы мобилизуются и клетки высвобождают жирные кислоты и глицерин. Норадреналин, выделяемый надпочечниками и постганглионарными симпатическими окончаниями, активирует гормончувствительную липазу, которая расщепляет триглицериды на поверхности липидных капель. Эта липаза также активируется гипофизарным гормоном роста. Свободные жирные кислоты диффундируют через мембраны адипоцитов и эндотелиальных клеток, выходят в кровоток и связываются с белком альбумином. Более гидрофильный глицерин свободно плавает в крови и поглощается печенью. Инсулин ингибирует гормончувствительную липазу[36]. Мобилизацию адипоцитов также запускают адреналин[37] и адренокортикотропный гормон[38][39].
Продукция гормонов
Молекулы, продуцируемые жировой тканью, играют важнейшую роль в поддержании метаболического гомеостаза, и нарушения в их образовании могут приводить к развитию ожирения и ряда патологических состояний, связанных с ожирением, поэтому жировую ткань рассматривают как эндокринный орган. Гормоны жировой ткани в совокупности называют адипокинами. Адипокины представляют собой разновидность цитокинов (сигнальных белков). Первым открытым адипокином стал гормон лептин, описанный в 1994 году. Лептин играет роль в поддержании нормальной массы тела и передаёт сигнал, свидетельствующий о насыщении, в гипоталамус. Лептин также контролирует липогенез в гепатоцитах, подавляя путь биосинтеза жирных кислот, и способствует окислению жирных кислот в мышцах. Наиболее обильно продуцируется адипокин, известный как адипонектин. Он повышает чувствительность к инсулину, и его введение мышам, страдающим ожирением, позволило частично преодолеть инсулинорезистентность. К числу адипокинов также относится фактор некроза опухоли α (TNFα), который вовлечён в формирование инсулинорезистентности за счёт подавления сигнального пути инсулина. В жировой ткани TNFα продуцируют макрофаги и другие иммунные клетки. У людей и мышей, страдающих ожирением, в жировой ткани возрастает экспрессия провоспалительного цитокина интерлейкина 6 (IL-6), однако его роль в метаболизме глюкозы неясна[30]. Также к числу адипокинов относят аспросин[40], резистин[41], апелин[42], хемерин[43], CCL2[44] и некоторые другие цитокины. Лептин и резистин продуцируются преимущественно подкожной жировой тканью[18]. Кроме того, и у женщин, и у мужчин жировая ткань является главным периферическим источником ароматазы, которая участвует в синтезе эстрогенов[45].
Развитие
Как и другие клетки соединительной ткани, адипоциты происходят от мезенхимальных стволовых клеток. Мезенхимальные стволовые клетки дают начало преадипоцитам, которые похожи на крупные фибробласты с цитоплазматическими липидными включениями. Первоначально липидные капли молодого белого адипоцита изолированы друг от друга, но вскоре они сливаются с образованием единой большой жировой капли. Белые адипоциты развиваются вместе с меньшей популяцией бежевых адипоцитов, которые присутствуют в зрелой белой жировой ткани. При адаптации к низким температурам белые адипоциты частично обратимо превращаются в бежевые, приобретают большое количество мелких липидных капель вместо одной крупной, их профиль экспрессии генов становится близок к таковому у бурых адипоцитов (в частности, возрастает экспрессия гена UCP1, кодирующего термогенин), и бежевые адипоциты приступают к термогенезу[23]. При возвращении к нормальным условиям часть бежевых адипоцитов вновь становятся белыми. У мышей «побурение» белой жировой ткани полностью нивелируется за 21 день после окончания пребывания на холоде, а снижение экспрессии UCP1, кодирующего термогенин, наступает уже через 24 часа[46]. При повторном попадании на холод в бежевые адипоциты превращаются каждый раз одни и те же белые адипоциты[47]. Превращение белого адипоцита в бежевый контролируется несколькими транскрипционными факторами[48]: PPARγ, PRDM16[49], PGC-1α и EBF2[50][51][52]. «Побурение» белого жира также стимулируют иризин, секретируемый мышечной тканью в ответ на физическую нагрузку[53], и FGF21, выделяемый печенью[54]. У мышей «побурение» стимулируют метионин-энкефалиновые пептиды, продуцируемые лимфоидными клетками врождённого иммунитета 2 типа в ответ на действие интерлейкина 33 (IL-33)[55].
Формирование запасов белой жировой ткани у человека начинается на 14-ой неделе внутриутробного развития. До рождения у плода уже имеется развитая подкожная и висцеральная жировая ткань. На поздних сроках беременности пролиферация клеток-предшественников адипоцитов замедляется, и до возраста 10 лет рост жировой ткани достигается за счёт увеличения объёма отдельных адипоцитов, а в подростковом возрасте начинается новая волна дифференцировки адипоцитов[23].
Клиническое значение
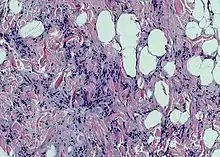
Белые адипоциты могут давать начало часто встречающимся доброкачественным образованиям — липомам. Злокачественные опухоли, происходящие из жировой ткани — липосаркомы — относительно редки[4].
Под ожирением понимают состояние, при котором в организме накапливается избыток жировой ткани[56]. Ожирение повышает риск возникновения многих заболеваний и патологических состояний: сердечно-сосудистых, сахарного диабета 2-го типа, обструктивного апноэ во сне, некоторых видов рака, а также остеоартрита[57]. Избыточное разрастание висцерального жира, в особенности вокруг желудка называют центральным, или висцеральным ожирением, а чрезмерно увеличенный, выдающийся живот при этом состоянии известен как «пивной живот». Поскольку жировая ткань продуцирует множество цитокинов, в том числе, и провоспалительных, ожирение часто сопровождается умеренным хроническим воспалением. Сахарный диабет и болезни сердца относят к воспалительным заболеваниям, связанным с ожирением[23]. Избыток жировой ткани, особенно висцерального жира, может приводить к появлению инсулинорезистентности[58]. У большинства пациентов, страдающих ожирением, адипоциты производят нормальное или повышенное количество лептина, однако иногда его клетки-мишени имеют недостаточно рецепторов лептина или несут дефектные рецепторы, поэтому эффект насыщения, опосредуемый лептином, не наступает[23]. Однако мутации в гене, кодирующем лептин, могут объяснить лишь небольшую долю случаев ожирения[59]. Весьма частой причиной развития ожирения у взрослых являются возрастные метаболические нарушения, при которых снижается активность гормончувствительной липазы. Повышенное количество адипоцитов, сформированных при детском ожирении, повышает риск ожирения у человека в старшем возрасте[60]. Конвертацию белой жировой ткани в бурую рассматривают как перспективную стратегию терапии ожирения[61].
В настоящее время белую жировую ткань можно использовать в качестве источника стволовых клеток у взрослых. Стволовые клетки жировой ткани можно легко перепрограммировать в индуцированные плюрипотентные стволовые клетки[62]. Получение стволовых клеток из клеточного материала самого организма пациента снижает риск отторжения трансплантата и позволяет избежать многих этических проблем, связанных с использованием эмбриональных стволовых клеток[63]. Имеются сведения, что стволовые клетки из разных локаций жировой ткани (абдоминального жира, эпикардиального жира и других) имеют разные свойства[63][64]: скорость пролиферации, иммунофенотип, потенциал дифференцировки и устойчивость к гипоксии[65].
История изучения
Белые адипоциты, или «жировые везикулы», а также их вклад в рост жировых отложений впервые были описаны в XIX веке. Активное исследование жировой ткани началось лишь в 1940-х годах. В 1940 году было показано, что жировая ткань иннервируется и снабжается кровью. В 1950-х годах была прояснена роль белых адипоцитов в метаболизме липидов, и дальнейшее изучение регуляции работы жировой ткани продолжалось во всей второй половине XX века[66]. Первые данные, свидетельствующие об эндокринной функции белой жировой ткани, появились в 1980-х годах[67].
Примечания
- Aarsland A., Chinkes D., Wolfe R. R. Hepatic and whole-body fat synthesis in humans during carbohydrate overfeeding. (англ.) // The American Journal Of Clinical Nutrition. — 1997. — June (vol. 65, no. 6). — P. 1774—1782. — doi:10.1093/ajcn/65.6.1774. — PMID 9174472.
- THOMAS LW. The chemical composition of adipose tissue of man and mice. (англ.) // Quarterly Journal Of Experimental Physiology And Cognate Medical Sciences. — 1962. — April (vol. 47). — P. 179—188. — doi:10.1113/expphysiol.1962.sp001589. — PMID 13920823.
- Афанасьев и др., 2004, с. 220—221.
- Mescher, 2016, p. 122.
- Mescher, 2016, p. 123.
- Афанасьев и др., 2004, с. 230—231.
- Афанасьев и др., 2004, с. 221.
- Афанасьев и др., 2004, с. 231.
- Афанасьев и др., 2004, с. 231—232.
- Nedergaard J., Bengtsson T., Cannon B. Unexpected evidence for active brown adipose tissue in adult humans. (англ.) // American Journal Of Physiology. Endocrinology And Metabolism. — 2007. — August (vol. 293, no. 2). — P. 444—452. — doi:10.1152/ajpendo.00691.2006. — PMID 17473055.
- Saito M., Okamatsu-Ogura Y., Matsushita M., Watanabe K., Yoneshiro T., Nio-Kobayashi J., Iwanaga T., Miyagawa M., Kameya T., Nakada K., Kawai Y., Tsujisaki M. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. (англ.) // Diabetes. — 2009. — July (vol. 58, no. 7). — P. 1526—1531. — doi:10.2337/db09-0530. — PMID 19401428.
- Graja A., Schulz T. J. Mechanisms of aging-related impairment of brown adipocyte development and function. (англ.) // Gerontology. — 2015. — Vol. 61, no. 3. — P. 211—217. — doi:10.1159/000366557. — PMID 25531079.
- Fat on the Inside: Looking Thin is Not Enough, By Fiona Haynes, About.com.
- Nagai M., Komiya H., Mori Y., Ohta T., Kasahara Y., Ikeda Y. Estimating visceral fat area by multifrequency bioelectrical impedance. (англ.) // Diabetes Care. — 2010. — May (vol. 33, no. 5). — P. 1077—1079. — doi:10.2337/dc09-1099. — PMID 20150289.
- Mazurek T., Zhang L., Zalewski A., Mannion J. D., Diehl J. T., Arafat H., Sarov-Blat L., O'Brien S., Keiper E. A., Johnson A. G., Martin J., Goldstein B. J., Shi Y. Human epicardial adipose tissue is a source of inflammatory mediators. (англ.) // Circulation. — 2003. — 18 November (vol. 108, no. 20). — P. 2460—2466. — doi:10.1161/01.CIR.0000099542.57313.C5. — PMID 14581396.
- Reduce Abdominal Fat. — «Estrogen causes fat to be stored around the pelvic region, hips, butt and thighs (pelvic region)». Дата обращения: 10 апреля 2009. Архивировано 28 сентября 2011 года.
- Waistline Worries: Turning Apples Back Into Pears. healthywomen.org. Архивировано 9 июня 2009 года.
- Katja Hoehn, Elaine N. Marieb. Anatomy & Physiology. — 3rd. — San Francisco, Calif. : Pearson/Benjamin Cummings, 2008. — ISBN 978-0-8053-0094-9.
- Andrews, Michelle A Matter of Fat. Yahoo Health. Women's Health (1 декабря 2006). Архивировано 15 марта 2007 года.
- Abdominal fat and what to do about it. President & Fellows of Harvard College (September 2005). — «Visceral fat more of a health concern than subcutaneous fat».
- The hypodermis (недоступная ссылка). An Organ Revealed. L'Oréal. Дата обращения: 4 июня 2013. Архивировано 10 декабря 2005 года.
- Saladin Kenneth. Human Anatomy. — Rex Bookstore, Inc., 2007. — P. 135, 478, 602. — ISBN 0071259716.
- Mescher, 2016, p. 125.
- Devlin M. J., Cloutier A. M., Thomas N. A., Panus D. A., Lotinun S., Pinz I., Baron R., Rosen C. J., Bouxsein M. L. Caloric restriction leads to high marrow adiposity and low bone mass in growing mice. (англ.) // Journal Of Bone And Mineral Research : The Official Journal Of The American Society For Bone And Mineral Research. — 2010. — September (vol. 25, no. 9). — P. 2078—2088. — doi:10.1002/jbmr.82. — PMID 20229598.
- Cawthorn W. P., Scheller E. L., Parlee S. D., Pham H. A., Learman B. S., Redshaw C. M., Sulston R. J., Burr A. A., Das A. K., Simon B. R., Mori H., Bree A. J., Schell B., Krishnan V., MacDougald O. A. Expansion of Bone Marrow Adipose Tissue During Caloric Restriction Is Associated With Increased Circulating Glucocorticoids and Not With Hypoleptinemia. (англ.) // Endocrinology. — 2016. — February (vol. 157, no. 2). — P. 508—521. — doi:10.1210/en.2015-1477. — PMID 26696121.
- Bredella M. A., Fazeli P. K., Miller K. K., Misra M., Torriani M., Thomas B. J., Ghomi R. H., Rosen C. J., Klibanski A. Increased bone marrow fat in anorexia nervosa. (англ.) // The Journal Of Clinical Endocrinology And Metabolism. — 2009. — June (vol. 94, no. 6). — P. 2129—2136. — doi:10.1210/jc.2008-2532. — PMID 19318450.
- Styner M., Pagnotti G. M., McGrath C., Wu X., Sen B., Uzer G., Xie Z., Zong X., Styner M. A., Rubin C. T., Rubin J. Exercise Decreases Marrow Adipose Tissue Through ß-Oxidation in Obese Running Mice. (англ.) // Journal Of Bone And Mineral Research : The Official Journal Of The American Society For Bone And Mineral Research. — 2017. — August (vol. 32, no. 8). — P. 1692—1702. — doi:10.1002/jbmr.3159. — PMID 28436105.
- Styner M., Pagnotti G. M., Galior K., Wu X., Thompson W. R., Uzer G., Sen B., Xie Z., Horowitz M. C., Styner M. A., Rubin C., Rubin J. Exercise Regulation of Marrow Fat in the Setting of PPARγ Agonist Treatment in Female C57BL/6 Mice. (англ.) // Endocrinology. — 2015. — August (vol. 156, no. 8). — P. 2753—2761. — doi:10.1210/en.2015-1213. — PMID 26052898.
- Styner M., Thompson W. R., Galior K., Uzer G., Wu X., Kadari S., Case N., Xie Z., Sen B., Romaine A., Pagnotti G. M., Rubin C. T., Styner M. A., Horowitz M. C., Rubin J. Bone marrow fat accumulation accelerated by high fat diet is suppressed by exercise. (англ.) // Bone. — 2014. — July (vol. 64). — P. 39—46. — doi:10.1016/j.bone.2014.03.044. — PMID 24709686.
- Colaianni Graziana, Colucci Silvia, Grano Maria. Anatomy and Physiology of Adipose Tissue (англ.) // Multidisciplinary Approach to Obesity. — 2014. — 15 October. — P. 3—12. — ISBN 9783319090443. — doi:10.1007/978-3-319-09045-0_1.
- Birbrair A., Zhang T., Wang Z. M., Messi M. L., Enikolopov G. N., Mintz A., Delbono O. Role of pericytes in skeletal muscle regeneration and fat accumulation. (англ.) // Stem Cells And Development. — 2013. — 15 August (vol. 22, no. 16). — P. 2298—2314. — doi:10.1089/scd.2012.0647. — PMID 23517218.
- Snel M., Jonker J. T., Schoones J., Lamb H., de Roos A., Pijl H., Smit J. W., Meinders A. E., Jazet I. M. Ectopic fat and insulin resistance: pathophysiology and effect of diet and lifestyle interventions. (англ.) // International Journal Of Endocrinology. — 2012. — Vol. 2012. — P. 983814—983814. — doi:10.1155/2012/983814. — PMID 22675355.
- Mescher, 2016, p. 123—124.
- Amitani M., Asakawa A., Amitani H., Inui A. The role of leptin in the control of insulin-glucose axis. (англ.) // Frontiers In Neuroscience. — 2013. — Vol. 7. — P. 51—51. — doi:10.3389/fnins.2013.00051. — PMID 23579596.
- Mescher, 2016, p. 124.
- Mescher, 2016, p. 124—125.
- Stallknecht B., Simonsen L., Bülow J., Vinten J., Galbo H. Effect of training on epinephrine-stimulated lipolysis determined by microdialysis in human adipose tissue. (англ.) // The American Journal Of Physiology. — 1995. — December (vol. 269, no. 6 Pt 1). — P. 1059—1066. — doi:10.1152/ajpendo.1995.269.6.E1059. — PMID 8572197.
- Spirovski M. Z., Kovacev V. P., Spasovska M., Chernick S. S. Effect of ACTH on lipolysis in adipose tissue of normal and adrenalectomized rats in vivo. (англ.) // The American Journal Of Physiology. — 1975. — February (vol. 228, no. 2). — P. 382—385. — doi:10.1152/ajplegacy.1975.228.2.382. — PMID 164126.
- Kiwaki K., Levine J. A. Differential effects of adrenocorticotropic hormone on human and mouse adipose tissue. (англ.) // Journal Of Comparative Physiology. B, Biochemical, Systemic, And Environmental Physiology. — 2003. — November (vol. 173, no. 8). — P. 675—678. — doi:10.1007/s00360-003-0377-1. — PMID 12925881.
- Romere C., Duerrschmid C., Bournat J., Constable P., Jain M., Xia F., Saha P. K., Del Solar M., Zhu B., York B., Sarkar P., Rendon D. A., Gaber M. W., LeMaire S. A., Coselli J. S., Milewicz D. M., Sutton V. R., Butte N. F., Moore D. D., Chopra A. R. Asprosin, a Fasting-Induced Glucogenic Protein Hormone. (англ.) // Cell. — 2016. — 21 April (vol. 165, no. 3). — P. 566—579. — doi:10.1016/j.cell.2016.02.063. — PMID 27087445.
- Wang H., Chu W. S., Hemphill C., Elbein S. C. Human resistin gene: molecular scanning and evaluation of association with insulin sensitivity and type 2 diabetes in Caucasians. (англ.) // The Journal Of Clinical Endocrinology And Metabolism. — 2002. — June (vol. 87, no. 6). — P. 2520—2524. — doi:10.1210/jcem.87.6.8528. — PMID 12050208.
- Guo L., Li Q., Wang W., Yu P., Pan H., Li P., Sun Y., Zhang J. Apelin inhibits insulin secretion in pancreatic beta-cells by activation of PI3-kinase-phosphodiesterase 3B. (англ.) // Endocrine Research. — 2009. — Vol. 34, no. 4. — P. 142—154. — doi:10.3109/07435800903287079. — PMID 19878074.
- MacDougald O. A., Burant C. F. The rapidly expanding family of adipokines. (англ.) // Cell Metabolism. — 2007. — September (vol. 6, no. 3). — P. 159—161. — doi:10.1016/j.cmet.2007.08.010. — PMID 17767903.
- Christiansen T., Richelsen B., Bruun J. M. Monocyte chemoattractant protein-1 is produced in isolated adipocytes, associated with adiposity and reduced after weight loss in morbid obese subjects. (англ.) // International Journal Of Obesity (2005). — 2005. — January (vol. 29, no. 1). — P. 146—150. — doi:10.1038/sj.ijo.0802839. — PMID 15520826.
- Stocco C. Tissue physiology and pathology of aromatase. (англ.) // Steroids. — 2012. — January (vol. 77, no. 1-2). — P. 27—35. — doi:10.1016/j.steroids.2011.10.013. — PMID 22108547.
- Gospodarska E., Nowialis P., Kozak L. P. Mitochondrial turnover: a phenotype distinguishing brown adipocytes from interscapular brown adipose tissue and white adipose tissue. (англ.) // The Journal Of Biological Chemistry. — 2015. — 27 March (vol. 290, no. 13). — P. 8243—8255. — doi:10.1074/jbc.M115.637785. — PMID 25645913.
- Rosenwald M., Perdikari A., Rülicke T., Wolfrum C. Bi-directional interconversion of brite and white adipocytes. (англ.) // Nature Cell Biology. — 2013. — June (vol. 15, no. 6). — P. 659—667. — doi:10.1038/ncb2740. — PMID 23624403.
- Lo K. A., Sun L. Turning WAT into BAT: a review on regulators controlling the browning of white adipocytes. (англ.) // Bioscience Reports. — 2013. — 6 September (vol. 33, no. 5). — doi:10.1042/BSR20130046. — PMID 23895241.
- Harms M. J., Ishibashi J., Wang W., Lim H. W., Goyama S., Sato T., Kurokawa M., Won K. J., Seale P. Prdm16 is required for the maintenance of brown adipocyte identity and function in adult mice. (англ.) // Cell Metabolism. — 2014. — 1 April (vol. 19, no. 4). — P. 593—604. — doi:10.1016/j.cmet.2014.03.007. — PMID 24703692.
- Wang W., Kissig M., Rajakumari S., Huang L., Lim H. W., Won K. J., Seale P. Ebf2 is a selective marker of brown and beige adipogenic precursor cells. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2014. — 7 October (vol. 111, no. 40). — P. 14466—14471. — doi:10.1073/pnas.1412685111. — PMID 25197048.
- Kissig M., Shapira S. N., Seale P. SnapShot: Brown and Beige Adipose Thermogenesis. (англ.) // Cell. — 2016. — 30 June (vol. 166, no. 1). — P. 258—258. — doi:10.1016/j.cell.2016.06.038. — PMID 27368105.
- Shapira S. N., Lim H. W., Rajakumari S., Sakers A. P., Ishibashi J., Harms M. J., Won K. J., Seale P. EBF2 transcriptionally regulates brown adipogenesis via the histone reader DPF3 and the BAF chromatin remodeling complex. (англ.) // Genes & Development. — 2017. — 1 April (vol. 31, no. 7). — P. 660—673. — doi:10.1101/gad.294405.116. — PMID 28428261.
- Boström P., Wu J., Jedrychowski M. P., Korde A., Ye L., Lo J. C., Rasbach K. A., Boström E. A., Choi J. H., Long J. Z., Kajimura S., Zingaretti M. C., Vind B. F., Tu H., Cinti S., Højlund K., Gygi S. P., Spiegelman B. M. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. (англ.) // Nature. — 2012. — 11 January (vol. 481, no. 7382). — P. 463—468. — doi:10.1038/nature10777. — PMID 22237023.
- Harms M., Seale P. Brown and beige fat: development, function and therapeutic potential. (англ.) // Nature Medicine. — 2013. — October (vol. 19, no. 10). — P. 1252—1263. — doi:10.1038/nm.3361. — PMID 24100998.
- Brestoff J. R., Kim B. S., Saenz S. A., Stine R. R., Monticelli L. A., Sonnenberg G. F., Thome J. J., Farber D. L., Lutfy K., Seale P., Artis D. Group 2 innate lymphoid cells promote beiging of white adipose tissue and limit obesity. (англ.) // Nature. — 2015. — 12 March (vol. 519, no. 7542). — P. 242—246. — doi:10.1038/nature14115. — PMID 25533952.
- Obesity and overweight Fact sheet N°311. WHO (January 2015). Дата обращения: 2 февраля 2016.
- Singh A. K., Corwin R. D., Teplitz C., Karlson K. E. Consecutive repair of complex congenital heart disease using hypothermic cardioplegic arrest--its results and ultrastructural study of the myocardium. (англ.) // The Thoracic And Cardiovascular Surgeon. — 1984. — February (vol. 32, no. 1). — P. 23—26. — doi:10.1055/s-2007-1023339. — PMID 6198769.
- Elmquist J. K., Maratos-Flier E., Saper C. B., Flier J. S. Unraveling the central nervous system pathways underlying responses to leptin. (англ.) // Nature Neuroscience. — 1998. — October (vol. 1, no. 6). — P. 445—450. — doi:10.1038/2164. — PMID 10196541.
- Morris D. L., Rui L. Recent advances in understanding leptin signaling and leptin resistance. (англ.) // American Journal Of Physiology. Endocrinology And Metabolism. — 2009. — December (vol. 297, no. 6). — P. 1247—1259. — doi:10.1152/ajpendo.00274.2009. — PMID 19724019.
- Mescher, 2016, p. 126.
- Giordano Antonio, Frontini Andrea, Cinti Saverio. Convertible visceral fat as a therapeutic target to curb obesity (англ.) // Nature Reviews Drug Discovery. — 2016. — 11 March (vol. 15, no. 6). — P. 405—424. — ISSN 1474-1776. — doi:10.1038/nrd.2016.31.
- Sugii S., Kida Y., Kawamura T., Suzuki J., Vassena R., Yin Y. Q., Lutz M. K., Berggren W. T., Izpisúa Belmonte J. C., Evans R. M. Human and mouse adipose-derived cells support feeder-independent induction of pluripotent stem cells. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2010. — 23 February (vol. 107, no. 8). — P. 3558—3563. — doi:10.1073/pnas.0910172106. — PMID 20133714.
- Atzmon G., Yang X. M., Muzumdar R., Ma X. H., Gabriely I., Barzilai N. Differential gene expression between visceral and subcutaneous fat depots. (англ.) // Hormone And Metabolic Research = Hormon- Und Stoffwechselforschung = Hormones Et Metabolisme. — 2002. — November (vol. 34, no. 11-12). — P. 622—628. — doi:10.1055/s-2002-38250. — PMID 12660871.
- Baglioni S., Cantini G., Poli G., Francalanci M., Squecco R., Di Franco A., Borgogni E., Frontera S., Nesi G., Liotta F., Lucchese M., Perigli G., Francini F., Forti G., Serio M., Luconi M. Functional differences in visceral and subcutaneous fat pads originate from differences in the adipose stem cell. (англ.) // PloS One. — 2012. — Vol. 7, no. 5. — P. e36569—36569. — doi:10.1371/journal.pone.0036569. — PMID 22574183.
- Russo V., Yu C., Belliveau P., Hamilton A., Flynn L. E. Comparison of human adipose-derived stem cells isolated from subcutaneous, omental, and intrathoracic adipose tissue depots for regenerative applications. (англ.) // Stem Cells Translational Medicine. — 2014. — February (vol. 3, no. 2). — P. 206—217. — doi:10.5966/sctm.2013-0125. — PMID 24361924.
- Lafontan Max. Historical perspectives in fat cell biology: the fat cell as a model for the investigation of hormonal and metabolic pathways (англ.) // American Journal of Physiology-Cell Physiology. — 2012. — 15 January (vol. 302, no. 2). — P. C327—C359. — ISSN 0363-6143. — doi:10.1152/ajpcell.00168.2011.
- Krug A. W., Ehrhart-Bornstein M. Newly discovered endocrine functions of white adipose tissue: possible relevance in obesity-related diseases. (англ.) // Cellular And Molecular Life Sciences : CMLS. — 2005. — June (vol. 62, no. 12). — P. 1359—1362. — doi:10.1007/s00018-005-4555-z. — PMID 15924267.
Литература
- Афанасьев Ю. И., Кузнецов С. Л., Юрина Н. А., Котовский Е. Ф. и др. Гистология, цитология и эмбриология. — 6-е изд., перераб. и доп.. — М.: Медицина, 2004. — 768 с. — ISBN 5-225-04858-7.
- Anthony L. Mescher. Junqueira's Basic Histology. — McGraw-Hill Education, 2016. — ISBN 978-0-07-184270-9.