Ацетил-СоА-карбоксилаза
Ацетил-СоА карбоксилаза (ACC) (Шифр КФ 6.4.1.2) — это биотинзависимый фермент, который катализирует необратимое карбоксилирование ацетил-СоА с образованием малонил-СоА благодаря двум каталитическим активностям: биотинкарбоксилазной (BC) и карбоксилтрансферазной (CT). У большинства прокариот и в хлоропластах большинства растений и водорослей ACC является ферментом с несколькими субъединицами. В цитоплазме большинства эукариот АСС является крупным многодоменным ферментом. Наиболее важной функцией ACC является обеспечение субстрата малонил-КоА для биосинтеза жирных кислот[1] Активность ACC может контролироваться на уровне транскрипции, а также с помощью модуляторов малых молекул и ковалентной модификации. Геном человека содержит гены для двух разных АСС[2]—ACACA[3] и ACACB[4].
| Ацетил-СоА-карбоксилаза | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 6.4.1.2 |
| Номер CAS | 9023-93-2 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9023-93-2 |
Структура
Прокариоты и растения имеют мультисубъединичную АСС, состоящую из нескольких полипептидов. Активность биотинкарбоксилазы (BC), белка-носителя карбоксила биотина (BCCP) и карбоксилтрансферазы (CT), сосредоточена в каждой отдельной субъединице. Стехиометрия этих субъединиц в холоферменте ACC различается у разных организмов[1]. Люди и большинство эукариот развили ACC с каталитическими доменами CT и BC и доменами BCCP на единственном полипептиде. Большинство растений также имеют эту гомомерную форму в цитозоле[5]. Функциональные области ACC, начинающиеся от N-конца до C-конца, представляют собой биотинкарбоксилазу (BC), связывающую биотин (BB), карбоксилтрансферазу (CT) и АТФ-связывающий мотив (AB). AB находится внутри BC. Биотин ковалентно присоединен через амидную связь к длинной боковой цепи лизина, находящегося в ВВ. Поскольку BB находится между участками BC и CT, биотин может легко перемещаться в оба активных центра, где это необходимо.
У млекопитающих, экспрессирующих две изоформы ACC, основным структурным различием между этими изоформами является удлиненный N-конец ACC2, содержащий митохондриальную целевую последовательность[1].
Гены
Полипептиды, составляющие мультисубъединичные АСС прокариот и растений, кодируются разными генами. У Escherichia coli accA кодирует альфа-субъединицу ацетил-КоА-карбоксилазы[6] а accD кодирует её бета-субъединицу[7].
Механизм
Общая реакция ACAC (A, B) протекает по двухступенчатому механизму[8]. Первая реакция осуществляется BC и включает АТФ-зависимое карбоксилирование биотина бикарбонатом, служащим источником CO2 . Карбоксильная группа переносится от биотина к ацетил-КоА с образованием малонил-КоА во второй реакции, которая катализируется CT.
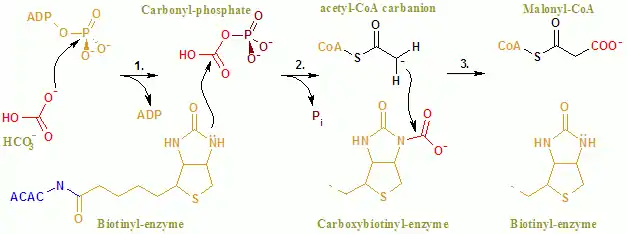
В активном центре реакция протекает при обширном взаимодействии остатков Glu296 и положительно заряженных Arg338 и Arg292 с субстратами[9]. Два Mg2+ координируются фосфатными группами на АТФ и необходимы для связывания АТФ с ферментом. Бикарбонат депротонируется Glu296, хотя в растворе этот перенос протона маловероятен, поскольку pKa бикарбоната составляет 10,3. Фермент, по-видимому, манипулирует pKa, чтобы облегчить депротонирование бикарбоната. PKa бикарбоната снижается за счет его взаимодействия с положительно заряженными боковыми цепями Arg338 и Arg292. Кроме того, Glu296 может взаимодействовать с боковой цепью Glu211, тем самым вызывая увеличение pKa. После депротонирования бикарбоната кислород бикарбоната действует как нуклеофил и атакует гамма-фосфат на АТФ. Промежуточный карбоксифосфат быстро разлагается до CO2 и PO43-. PO43- депротонирует биотин, создавая енолят, стабилизированный Arg338, который впоследствии атакует CO2, что приводит к образованию карбоксибиотина. Карбоксибиотин перемещается в активный центр карбоксилтрансферазы (СТ), где карбоксильная группа переносится на ацетил-КоА. В отличие от домена BC, о механизме реакции CT известно немного. Предлагаемый механизм — это высвобождение CO2 из биотина, который впоследствии отрывает протон от метильной группы от ацетил-CoA-карбоксилазы. Полученный енолят атакует CO2 с образованием малонил-КоА. В конкурирующем механизме отрыв протона согласован с атакой ацетил-КоА.
Функция
Функция ACC — регуляция метаболизма жирных кислот. Когда фермент активен, образуется продукт малонил-КоА, который является строительным блоком для новых жирных кислот и может ингибировать перенос жирной ацильной группы от ацил-КоА к карнитину с помощью карнитинацилтрансферазы, которая ингибирует бета-окисление жирные кислоты в митохондриях .
У млекопитающих экспрессируются две основные изоформы ACC, ACC1 и ACC2, которые различаются как распределением в тканях, так и функцией. ACC1 находится в цитоплазме всех клеток, но он обогащен липогенными тканями, такими как жировая ткань и лактирующие молочные железы, где важен синтез жирных кислот[10]. В окислительных тканях, таких как скелетные мышцы и сердце, соотношение экспрессируемого АСС2 выше. И ACC1, и ACC2 высоко экспрессируются в печени, где важны как окисление, так и синтез жирных кислот[11]. Различия в распределении тканей указывают на то, что ACC1 поддерживает регуляцию синтеза жирных кислот, тогда как ACC2 в основном регулирует окисление жирных кислот (бета-окисление).
Регуляция

Регуляция ACC млекопитающих сложна, она контролирует два различных пула малонил КоА, которые направляются либо на ингибирование бета-окисления, либо на активацию биосинтеза липидов[12].
ACC1 и ACC2 млекопитающих регулируются транскрипционно множеством промоторов, которые опосредуют изобилие ACC в ответ на состояние питания клеток. Активация экспрессии генов через разные промоторы приводит к альтернативному сплайсингу; однако физиологическое значение конкретных изоферментов ACC остается неясным[11]. Чувствительность к статусу питания является результатом контроля этих промоторов факторами транскрипции, такими как белок 1, связывающий регуляторный элемент стерола, контролируемый инсулином на уровне транскрипции, и ChREBP, экспрессия которого увеличивается при диете с высоким содержанием углеводов[13][14].
Через петлю прямой связи цитрат аллостерически активирует АСС[15]. Цитрат может увеличить полимеризацию АСС для увеличения ферментативной активности; однако неясно, является ли полимеризация основным механизмом цитрата увеличения активности АСС или полимеризация является артефактом экспериментов in vitro. Другие аллостерические активаторы включают глутамат и другие дикарбоновые кислоты[16]. Длинноцепочечные и короткоцепочечные жирные ацил-КоА являются ингибиторами АСС с отрицательной обратной связью[17].
Фосфорилирование может происходить, когда гормоны глюкагон или адреналин связываются с рецепторами клеточной поверхности, но основная причина фосфорилирования связана с повышением уровня АМФ при низком энергетическом статусе клетки, что приводит к активации АМФ-активируемой протеинкиназы. (AMPK). AMPK является основным регулятором киназы ACC, способным фосфорилировать ряд сериновых остатков на обеих изоформах ACC[18]. На ACC1 AMPK фосфорилирует Ser79, Ser1200 и Ser1215. Протеинкиназа А также обладает способностью фосфорилировать АСС с гораздо большей способностью фосфорилировать АСС2, чем АСС1. Однако физиологическое значение протеинкиназы A в регуляции ACC в настоящее время неизвестно. Исследователи предполагают, что существуют другие киназы ACC, важные для его регуляции, поскольку существует множество других возможных сайтов фосфорилирования на ACC[19].
Когда инсулин связывается со своими рецепторами на клеточной мембране, он активирует фермент фосфатазу, называемый протеинфосфатазой 2A (PP2A), для дефосфорилирования фермента; тем самым снимая ингибирующий эффект. Кроме того, инсулин индуцирует фосфодиэстеразу, которая снижает уровень цАМФ в клетке, таким образом ингибируя PKA, а также напрямую ингибирует AMPK.
Этот белок может использовать морфеиновую модель аллостерической регуляции[20].
Клиническое значение
На стыке путей синтеза и окисления липидов ACC представляет множество клинических возможностей для производства новых антибиотиков и разработки новых методов лечения диабета, ожирения и других проявлений метаболического синдрома[21]. Исследователи стремятся использовать структурные различия между бактериальными и человеческими ACC для создания антибиотиков, специфичных для бактериальных ACC, чтобы минимизировать побочные эффекты для пациентов. Многообещающие результаты в отношении полезности ингибитора АСС включают открытие, что мыши без экспрессии АСС2 имеют непрерывное окисление жирных кислот, снижение массы жира и уменьшение массы тела, несмотря на увеличение потребления пищи. Эти мыши также защищены от диабета[12]. Недостаток ACC1 у мутантных мышей летален уже на эмбриональной стадии. Однако неизвестно, должны ли лекарственные средства, нацеленные на ACC у людей, быть специфичными для ACC2[22].
Фирсокостат (ранее GS-976, ND-630, NDI-010976) является мощным аллостерическим ингибитором ACC, действующим на BC-домен ACC[23]. Фирсокостат разрабатывается фармацевтической компанией Gilead в 2019 году (фаза II)[24] как часть комбинированного лечения неалкогольного стеатогепатита (НАСГ), который, как считается, является все более частой причиной печеночной недостаточности[25].
Кроме того, селективные к растениям ингибиторы АЦК широко используются в качестве гербицидов[26] что предполагает клиническое применение против паразитов Apicomplexa, которые зависят от изоформы АЦК растительного происхождения[27], включая малярию .
Примечания
- “Acetyl-coenzyme A carboxylase: crucial metabolic enzyme and attractive target for drug discovery”. Cellular and Molecular Life Sciences. 62 (16): 1784—803. August 2005. DOI:10.1007/s00018-005-5121-4. PMID 15968460.
- “Isoforms of acetyl-CoA carboxylase: structures, regulatory properties and metabolic functions”. Biochemical Society Transactions. 25 (4): 1232—8. November 1997. DOI:10.1042/bst0251232. PMID 9449982.
- “Human acetyl-CoA carboxylase: characterization, molecular cloning, and evidence for two isoforms”. Proceedings of the National Academy of Sciences of the United States of America. 92 (9): 4011—5. April 1995. Bibcode:1995PNAS...92.4011A. DOI:10.1073/pnas.92.9.4011. PMID 7732023.
- “Identification of a second human acetyl-CoA carboxylase gene”. The Biochemical Journal. 316 (3): 915—22. June 1996. DOI:10.1042/bj3160915. PMID 8670171.
- “Plant acetyl-CoA carboxylase: structure, biosynthesis, regulation, and gene manipulation for plant breeding”. Bioscience, Biotechnology, and Biochemistry. 68 (6): 1175—84. June 2004. DOI:10.1271/bbb.68.1175. PMID 15215578.
- accA, acetyl-CoA carboxylase alpha subunit (Escherichia coli str. K-12 substr. MG1655). NCBI gene. National Center for Biotechnology Information, U.S. National Library of Medicine.
- accD, acetyl-CoA carboxylase beta subunit (Escherichia coli str. K-12 substr. MG1655). NCBI gene. National Center for Biotechnology Information, U.S. National Library of Medicine.
- “Biotinoyl domain of human acetyl-CoA carboxylase: Structural insights into the carboxyl transfer mechanism”. Proteins. 72 (2): 613—24. August 2008. DOI:10.1002/prot.21952. PMID 18247344.
- “Crystal structure of biotin carboxylase in complex with substrates and implications for its catalytic mechanism”. The Journal of Biological Chemistry. 284 (17): 11690—7. April 2009. DOI:10.1074/jbc.M805783200. PMID 19213731.
- “Promoter usage determines tissue specific responsiveness of the rat acetyl-CoA carboxylase gene”. Biochemical and Biophysical Research Communications. 225 (2): 647—53. August 1996. DOI:10.1006/bbrc.1996.1224. PMID 8753813.
- “Structure and regulation of acetyl-CoA carboxylase genes of metazoa”. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1733 (1): 1—28. March 2005. DOI:10.1016/j.bbalip.2004.12.001. PMID 15749055.
- “Continuous fatty acid oxidation and reduced fat storage in mice lacking acetyl-CoA carboxylase 2”. Science. 291 (5513): 2613—6. March 2001. Bibcode:2001Sci...291.2613A. DOI:10.1126/science.1056843. PMID 11283375.
- “Polyunsaturated fatty acids decrease the expression of sterol regulatory element-binding protein-1 in CaCo-2 cells: effect on fatty acid synthesis and triacylglycerol transport”. The Biochemical Journal. 368 (Pt 3): 855—64. December 2002. DOI:10.1042/BJ20020731. PMID 12213084.
- “Carbohydrate response element binding protein directly promotes lipogenic enzyme gene transcription”. Proceedings of the National Academy of Sciences of the United States of America. 101 (44): 15597—602. November 2004. Bibcode:2004PNAS..10115597I. DOI:10.1073/pnas.0405238101. PMID 15496471.
- “The mechanism of tricarboxylic acid cycle regulation of fatty acid synthesis”. The Journal of Biological Chemistry. 237: 1787—92. June 1962. PMID 14470343.
- “Bimodal activation of acetyl-CoA carboxylase by glutamate”. The Journal of Biological Chemistry. 275 (15): 10819—25. April 2000. DOI:10.1074/jbc.275.15.10819. PMID 10753875.
- “Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling”. The Biochemical Journal. 323 (Pt 1): 1—12. April 1997. DOI:10.1042/bj3230001. PMID 9173866.
- “Phosphorylation-activity relationships of AMPK and acetyl-CoA carboxylase in muscle”. Journal of Applied Physiology. 92 (6): 2475—82. June 2002. DOI:10.1152/japplphysiol.00071.2002. PMID 12015362.
- “Regulation of acetyl-CoA carboxylase”. Biochemical Society Transactions. 34 (Pt 2): 223—7. April 2006. DOI:10.1042/BST20060223. PMID 16545081.
- “Dynamic dissociating homo-oligomers and the control of protein function”. Archives of Biochemistry and Biophysics. 519 (2): 131—43. March 2012. DOI:10.1016/j.abb.2011.11.020. PMID 22182754.
- “Inhibitors of mammalian acetyl-CoA carboxylase”. Recent Patents on Cardiovascular Drug Discovery. 2 (3): 162—80. November 2007. DOI:10.2174/157489007782418928. PMID 18221116.
- “Mutant mice lacking acetyl-CoA carboxylase 1 are embryonically lethal”. Proceedings of the National Academy of Sciences of the United States of America. 102 (34): 12011—6. August 2005. Bibcode:2005PNAS..10212011A. DOI:10.1073/pnas.0505714102. PMID 16103361.
- “Acetyl-CoA carboxylase inhibition by ND-630 reduces hepatic steatosis, improves insulin sensitivity, and modulates dyslipidemia in rats”. Proceedings of the National Academy of Sciences of the United States of America. 113 (13): E1796—805. March 2016. Bibcode:2016PNAS..113E1796H. DOI:10.1073/pnas.1520686113. PMID 26976583.
- Gilead shores up hope for NASH cocktail with a glimpse at positive proof-of-concept data. Endpoints News (11 April 2019).
- “A systematic review of the present and future of non-alcoholic fatty liver disease”. Clinical and Experimental Hepatology. 4 (3): 165—174. September 2018. DOI:10.5114/ceh.2018.78120. PMID 30324141.
- Al-Khatib. Acetyl CoA Carboxylase (ACCase) Inhibitors. Herbicide Symptoms. Division of Agriculture and Natural Resources, University of California, Davis.
- “Growth of Toxoplasma gondii is inhibited by aryloxyphenoxypropionate herbicides targeting acetyl-CoA carboxylase”. Proceedings of the National Academy of Sciences of the United States of America. 96 (23): 13387—92. November 1999. Bibcode:1999PNAS...9613387Z. DOI:10.1073/pnas.96.23.13387. PMID 10557330.
Дальнейшее чтение
- Voet, Donald. Biochemistry / Donald Voet, Judith G. Voet. — 3rd. — Wiley, 2004. — ISBN 978-0-471-19350-0.
- Biochemistry and molecular biology of plants. — American Society of Plant Physiologists, 2000. — ISBN 978-0-943088-37-2.
- Levert KL, Waldrop GL, Stephens JM (May 2002). “A biotin analog inhibits acetyl-CoA carboxylase activity and adipogenesis”. The Journal of Biological Chemistry. 277 (19): 16347—50. DOI:10.1074/jbc.C200113200. PMID 11907024.