Триметилхлорсилан
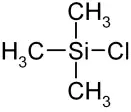
Триметилхлорсилан (хлортриметилсилан) — кремнийорганическое вещество с химической формулой (CH3)3SiCl. Широко используется в органическом синтезе, в основном в качестве защитной группы. Может быть получен по реакции метиллития с четырёххлористым кремнием. Однако он легко коммерчески доступен.
| Триметилхлорсилан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
триметилхлорсилан | ||
| Сокращения | TMSCl | ||
| Хим. формула | (CH3)3SiCl | ||
| Рац. формула | С3H9SiCl | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 108.64 г/моль | ||
| Плотность | 0,854 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | - 57,7 °C | ||
| • кипения | 57,3 °C | ||
| • вспышки | - 28 °C | ||
| Давление пара | 253 гПа (20 °C) | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | водой быстро гидролизуется | ||
| • в апротонных растворителях | смешивается | ||
| Оптические свойства | |||
| Показатель преломления | 1,3885 | ||
| Структура | |||
| Гибридизация | тетраэдрическая при кремнии | ||
| Классификация | |||
| Рег. номер CAS | 75-77-4 | ||
| PubChem | 6397 | ||
| Рег. номер EINECS | 200-900-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | VV2710000 | ||
| ChEBI | 85069 | ||
| ChemSpider | 6157 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
Бесцветная подвижная жидкость с резким запахом и низкой температурой кипения. Дымит во влажном воздухе. Устойчива в отсутствии влаги. Смешивается с апротонными растворителями такими как гексан, бензол, толуол, диэтиловый эфир, тетрагидрофуран, хлороформ, дихлорметан, этилацетат и др.
Получение
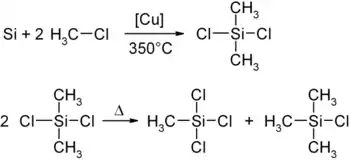
В промышленности его получают совместно с диметилдихлорсиланом и метилтрихлорсиланом (синтез Мюллера — Рохова[1], в котором порошкообразный кремний в присутствии порошка меди и окиси меди реагирует с хлорметаном при 350 °C с образованием диметилдихлорсилана, диспропорционирующего in situ на триметилхлорсилан и метилтрихлорсилан).
Разделение смеси метилхлорсиланов производится дистилляцией.
Химические свойства
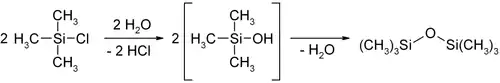
Триметилхлорсилан типичное электрофильное вещество, атом кремния очень легко атакуется нуклеофилами. Это проявляется в легкости гидролиза с выделением тепла, в ходе которого образуется хлороводород и триметилсиланол. Последний димеризуется с выделением воды, образуя гексаметилдисилоксан.
При взаимодействии с восстановителями (например алюмогидрид лития) образуется триметилсилан (CH3)3SiH.
Применение
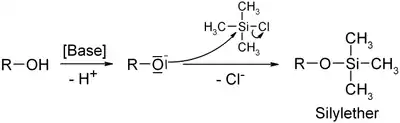
- Триметилхлорсилан широко используется в органическом синтезе как источник триметилсилильной группы, так и безводный источник хлорида. Функциональные группы спиртов и аминов легко поддаются реакции с триметилхлорсиланом, образуя триметилсилильные эфиры или триметилсилильные амины. Полученные группы могут быть использованы как защитные группы
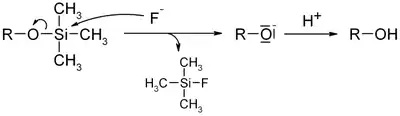
- однако лабильность триметилсиланового фрагмента ограничивает такое их применение. Так триметилсилильная группа может быть снята фторид ионом из-за высокого сродства кремния к фтору
- Триметилсилилирование увеличивает летучесть вещества, что используется в газовой хроматографии при анализе таких нелетучих веществ, как глюкоза
- Триметилхлорсилан реагирует с ацетиленидами металлов, образуя триметилсилилалкины, которые являются защищённой формой алкинов.
- Триметилхлорсилан реагирует со спиртами с образованием хлороводорода, что может быть использовано для получения безводных растворов хлороводорода в спирте — что, в свою очередь, может быть использовано в получении в мягких условиях сложных эфиров из карбоновых кислот и кеталей из кетонов.
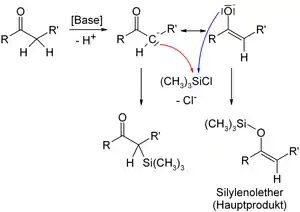
- В присутствии триэтиламина или диизопропиламида лития енолизируемые альдегиды, кетоны и сложные эфиры превращаются в триметилсилильные эфиры енолов:
 : :
: :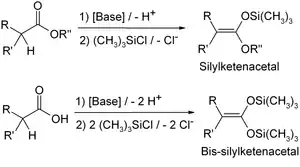
Несмотря на их гидролитическую нестабильность этих веществ, они нашли широкое применение в органической химии. Окисление двойной связи эпоксидированием таких силилированных енолов с дальнейшим гидролизом может быть использовано для введения гидроксигруппы в α-положение к карбонильной группе. Триметилсилиловые эфиры енолов могут также быть использованы в качестве эквивалента енола в конденсации Мукайямы[2][3] альдольной конденсации.
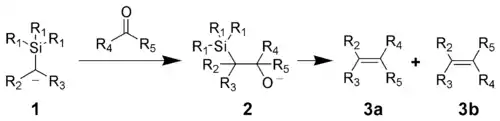
- Триметилхлорсилан используется для С-силилирования карбанионов, реактивов Гриньяра и литийорганических соединений, за счет индуктивного эффекта такие силилированные соединения с атомом водорода в α-положении приобретают свойства CH-кислот. Присоединение стабилизированных триметилсилильной группой α-карбанионов (1) к карбонильным соединениям ведет к образованию β-гидроксисиланов (2) и дальнейшему элиминированию триметилсиланола с образованием алкена (3a, 3b):
В случае электронакцепторных заместителей в α-триметилсилильном карбанионе реакция идет по механизму, близкому к реакции Виттига и протекает стереоселективно. Этот метод используется для синтеза алкенов из карбонильных соединений (реакция Петерсона).
Очистка
В лаборатории перед использованием очищается перегонкой над CaH2.
Безопасность
Триметилхлорсилан легколетуч и легковоспламеним с низкой температурой вспышки. При контакте с кожей и глазами вызывает сильные ожоги. Гидролизуется на воздухе с образованием хлороводорода. Работа с ним ведётся в вытяжном шкафу и необходимыми средствами защиты: очки, резиновые перчатки. Триметилхлорсилан желательно хранить в азотной атмосфере в коррозионностойкой таре.
Примечания
- X.Беккер, Г.Домшке, Э.Фангхенель и др. Органикум, том 1, стр. 109 — М.: Мир, 1992. ISBN 5-03-001965-0
- Дж. Дж. Ли Именные реакции. Пер. с англ. М., Бином 2006, с. 238
- en:Mukaiyama aldol addition