Реакция Виттига
Реакция Виттига — химическая реакция альдегидов или кетонов с илидами фосфора (которые иногда называют «реагентами Виттига»), которая приводит к образованию алкенов или алленов и оксида трифенилфосфина[1][2].

Реакция была открыта в 1954 году Георгом Виттигом. За открытие этой реакции он был награждён Нобелевской премией в области химии в 1979 году.
Реакции Виттига широко используется в органическом синтезе для получения алкенов[3][4][5].
Реакцию Виттига не следует путать с перегруппировкой Виттига.
Механизм реакции
Классический механизм
При нуклеофильном присоединении илида 1 к карбонильному соединению образуется бетаин 3, который вследствие свободного вращения вокруг связи С-С может переходить в конформер 4. Последний способен быстро и обратимо изомеризоваться, образуя четырехчленный оксафосфетановый цикл (соединение 5). Элиминирование оксида трифенилфосфина 6 приводит к образованию Z-изомера целевого алкена 7.
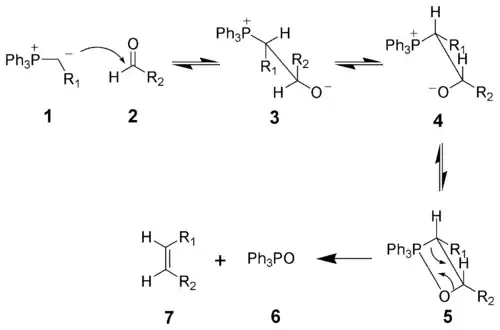
Изомеризация бетаина 4 в оксафосфетан 5 является лимитирующей стадией реакции. Скорость реакции нуклеофильного присоединения илида к карбонильному соединению сильно зависит от природы илида. В случае незамещенного илида (R1 = H) присоединение проходит относительно быстро с подавляющим большинством альдегидов и кетонов. Однако в случае «стабилизированных реагентов Виттига» (R1 = электроноакцепторная группа) скорость нуклеофильного присоединения значительно снижается, что приводит к уменьшению скорости реакции в целом. Также возрастает количество побочного продукта в виде E-изомера алкена. Кроме этого, «стабилизированные реагенты Виттига» практически не взаимодействуют со стерически затрудненными альдегидами и кетонами.
Стадия элиминирования с образованием продукта протекает из интермедиата, а не устойчивого выделяемого соединения. Этот интермедиат образуется в реакции in situ и самопроизвольно разлагается. Следовательно, реакция Виттига является еще одной реакцией олефинирования, но, в отличие от реакции Жулия или реакции Петерсона, протекает в одну стадию, и поэтому намного более распространена.
Реагенты Виттига
Получение илидов фосфора
Реагенты Виттига обычно получают из соответствующих солей фосфония, которые в свою очередь образуются в результате реакции трифенилфосфина с алкилгалогенидами. Триалкилфосфониевая соль депротонируется сильными основаниями, такими как н-бутиллитий:
[Ph3P+CH2R]X− + C4H9Li → Ph3P=CHR + LiX + C4H10
Примечания
- Georg Wittig, Ulrich Schöllkopf. Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien I (нем.) // Chemische Berichte : magazin. — 1954. — Bd. 87. — S. 1318. — doi:10.1002/cber.19540870919.
- Georg Wittig, Werner Haag. Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien II (нем.) // Chemische Berichte : magazin. — 1955. — Bd. 88. — S. 1654—1666. — doi:10.1002/cber.19550881110.
- Maercker, A. Org. React. 1965, 14, 270—490. (Review)
- W. Carruthers, Some Modern Methods of Organic Synthesis, Cambridge University Press, Cambridge, UK, 1971, pp81-90. (ISBN 0-521-31117-9)
- R. W. Hoffmann. Wittig and His Accomplishments: Still Relevant Beyond His 100th Birthday (англ.) // Angewandte Chemie : journal. — 2001. — Vol. 40, no. 8. — P. 1411—1416. — doi:10.1002/1521-3773(20010417)40:8<1411::AID-ANIE1411>3.0.CO;2-U.
Литература
- Обзорные статьи
- Maryanoff B. E., Reitz A. B. The Wittig olefination reaction and modifications involving phosphoryl-stabilized carbanions. Stereochemistry, mechanism, and selected synthetic aspects (англ.) // Chem. Rev. — 1989. — Vol. 89, no. 4. — P. 863—927. — doi:10.1021/cr00094a007.
- Byrne P. A., Gilheany D. G. The modern interpretation of the Wittig reaction mechanism (англ.) // Chem. Soc. Rev. — 2013. — Vol. 42. — P. 6670—6696. — doi:10.1039/C3CS60105F.