Карбанион
При присоединении лишнего электрона к атому углерода (это происходит, когда при отщеплении какого-либо атома или группы атомов оба общих электрона, образующих связь, остаются при углеродном атоме) образуется отрицательно заряженный атом - карбанион[1].
R:Y -> R-': + Y+
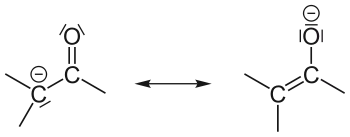
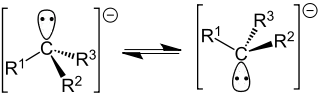
Карбанион — анион, содержащий чётное число электронов со свободной электронной парой на четырехвалентном атоме углерода. К карбанионам относят как анионы с локализованным на углеродном атоме отрицательным зарядом, так и анионы с делокализованным отрицательным зарядом, у которых по крайней мере в одной из канонических структур заряд локализован на атоме углерода[2]:
Свойства
Карбанионы являются сопряженными основаниями для углеводородов, выступающих в роли кислот Льюиса.
Карбанионные центры могут находиться в состоянии sp3-гибридизации (например, Cl3C-), промежуточном состоянии между sp3 и sp2-гибридизациями (например, в енолят-анионах) и sp1-гибридизации (в ацетиленидах R-С≡C-).
Способы получения
- Ионизация под действием растворителя для металл-органических соединений.
- Действие сильных оснований на достаточно кислую (поляризованную) связь C-H.
- Присоединение анионов по кратным связям.
Факторы стабилизации
- Пространственный фактор — экранирование реакционного центра.
- Резонансный фактор — чем больше резонансных структур имеет карбанион, тем более он стабилен.
- Природа и положение заместителей в углеродной цепи — акцепторные заместители стабилизируют карбанион.
Химические свойства
- Взаимодействие с электрофилами.
- Окисление до радикалов.
Примечания
- Степаненко Б.Н. Курс органической химии. — 600 с.
- carbanion // IUPAC Gold Book
Литература
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.