Терминатор (молекулярная биология)
Термина́тор (англ. Terminator) — нуклеотидная последовательность ДНК, на которой завершается транскрипция гена или оперона. Как правило, последовательность терминатора такова, что комплементарная ей последовательность в мРНК вызывает выход новосинтезированного транскрипта из транскрипционного комплекса. Эта последовательность в мРНК может сама по себе вызывать терминацию за счёт собственной вторичной структуры, а может привлекать особые белки — факторы терминации. После высвобождения РНК-полимераза и транскрипционные факторы приступают к транскрипции другого гена.
У прокариот
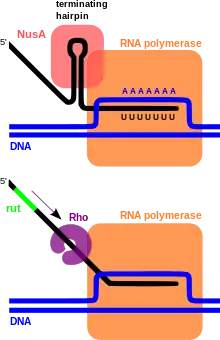
У прокариот существует два механизма терминации: ро-зависимый и ро-независимый. Ро-зависимые терминаторы функционируют посредством особого белка — ро-фактора, который обладает РНК-хеликазной активностью и разрушает комплекс ДНК, мРНК и РНК-полимеразы. Ро-зависимые терминаторы встречаются у бактерий и фагов. Ро-зависимые терминаторы находятся ниже стоп-кодона, на котором завершается трансляция, и представляют собой неструктурированные, обогащённые цитозином последовательности в мРНК, известные как rut-сайты (от англ. Rho utilization site), после которых находятся точки остановки транскрипции (англ. tsp от transcription stop point)[1]. Консенсусная последовательность для rut-сайтов не установлена. Rut-сайт выступает в роли места посадки ро-фактора на мРНК и его активатора. Активированный ро-фактор начинает гидролизовать АТФ и за счёт энергии гидролиза движется вдоль мРНК, пока не столкнётся с РНК-полимеразой, остановившейся на tsp-сайте. Контакт между ро-фактором и РНК-полимеразой стимулирует распад транскрипционного комплекса за счёт аллостерических эффектов ро-фактора на РНК-полимеразу[2][3].
Ро-независимые терминаторы формируют шпильки в структуре синтезирующегося транскрипта, которые при столкновении с РНК-полимеразой вызывают диссоциацию комплекса ДНК, мРНК и РНК-полимеразы. Типичный ро-независимый терминатор состоит из 20 нуклеотидов, обогащён парами GC и обладает диадной симметрией, а вслед за ним следует обогащённый тимином участок (поли(Т)-тракт), которому в мРНК соответствует участок, обогащённый урацилом. Предположительный механизм работы ро-независимых терминаторов заключается в том, что шпилька вызывает остановку РНК-полимеразы, из-за которой повышается вероятность диссоциации фермента от матрицы[4][5]. Кроме того, со шпилькой взаимодействует фактор элонгации транскрипции NusA, который способствует терминации транскрипции[6].
У эукариот
У эукариот сигналы терминации транскрипции распознаются факторами терминации, которые взаимодействуют с РНК-полимеразой II и ускоряют процесс терминации. Когда в мРНК синтезируется сигнал полиаденилирования, то белки CPSF (от англ. cleavage and polyadenylation specificity factor) и CstF (от англ. cleavage stimulation factor) переходят на него с C-концевого домена РНК-полимеразы II. Эти два фактора затем привлекают другие белки, которые вносят разрыв в транскрипт, высвобождая мРНК из транскрипционного комплекса, и добавляют к 3'-концу мРНК хвост из приблизительно 200 адениновых нуклеотидов в ходе процесса, известного как полиаденилирование. В это время РНК-полимераза продолжает транскрипцию ещё от нескольких сотен до нескольких тысяч нуклеотидов и в конце концов диссоциирует с ДНК по не до конца известному механизму. Существуют две основные гипотезы на этот счёт: модель торпедо и аллостерическая модель[7][8].
Когда синтез собственно мРНК завершён и в неё внесён разрыв в сигнале полиаденилирования, оставшаяся слева от разрыва часть транскрипта всё ещё комплементарно связана с ДНК и РНК-полимеразой, которая продолжает транскрипцию. Далее экзонуклеаза связывается с остатком транскрипта, всё ещё связанным с матрицей, и начинает отщеплять по одному нуклеотиду с его 5'-конца, постепенно приближаясь к продолжающей транскрипцию РНК-полимеразе II. У человека в роли такой экзонуклеазы выступает белок XRN2. В конце концов, согласно модели торпедо, экзонуклеаза «догоняет» РНК-полимеразу II и сталкивает её с матрицы, разрушая остаточный транскрипт и вызывая терминацию транскрипции. XRN2 может не сталкивать фермент с ДНК, а «выбивать» ДНК из-под него[9]. Механизм этого процесса неясен, и маловероятно, что в его основе лежит только лишь диссоциация[10].
Согласно альтернативной модели, известной как аллостерическая модель, терминация обусловлена структурными изменениями в РНК-полимеразе, которые вызваны взаимодействием с определёнными белками или, напротив, утратой связи с другими. Структурные изменения РНК-полимеразы приводят к тому, что она диссоциирует с матрицы, причём они происходят уже после того, как РНК-полимераза синтезирует сигнал полиаденилирования. Когда РНК-полимераза синтезирует сигнал полиаденилирования, она претерпевает конформационные изменения, в результате которых с её C-концевого домена уходят определённые белки. Конформационные изменения снижают процессивность РНК-полимеразы, повышая вероятность её диссоциации. В этой модели, известной как аллостерическая модель, терминация обусловлена не разрушением остатков транскрипта, а снижением эффективности работы РНК-полимеразы, которое повышает вероятность её диссоциации[7].
Примечания
- Richardson Lislott V., Richardson John P. Rho-dependent Termination of Transcription Is Governed Primarily by the Upstream Rho Utilization (rut) Sequences of a Terminator (англ.) // Journal of Biological Chemistry. — 1996. — 30 August (vol. 271, no. 35). — P. 21597—21603. — ISSN 0021-9258. — doi:10.1074/jbc.271.35.21597.
- Ciampi M. S. Rho-dependent terminators and transcription termination. (англ.) // Microbiology (Reading, England). — 2006. — September (vol. 152, no. Pt 9). — P. 2515—2528. — doi:10.1099/mic.0.28982-0. — PMID 16946247.
- Epshtein V., Dutta D., Wade J., Nudler E. An allosteric mechanism of Rho-dependent transcription termination. (англ.) // Nature. — 2010. — 14 January (vol. 463, no. 7278). — P. 245—249. — doi:10.1038/nature08669. — PMID 20075920.
- von Hippel P. H. An Integrated Model of the Transcription Complex in Elongation, Termination, and Editing (англ.) // Science. — 1998. — 31 July (vol. 281, no. 5377). — P. 660—665. — doi:10.1126/science.281.5377.660.
- Gusarov Ivan, Nudler Evgeny. The Mechanism of Intrinsic Transcription Termination (англ.) // Molecular Cell. — 1999. — April (vol. 3, no. 4). — P. 495—504. — ISSN 1097-2765. — doi:10.1016/S1097-2765(00)80477-3.
- Santangelo T. J., Artsimovitch I. Termination and antitermination: RNA polymerase runs a stop sign. (англ.) // Nature Reviews. Microbiology. — 2011. — May (vol. 9, no. 5). — P. 319—329. — doi:10.1038/nrmicro2560. — PMID 21478900.
- Watson, J. Molecular Biology of the Gene (англ.). — Cold Spring Harbor Laboratory Press, 2008. — P. 410—411. — ISBN 978-0-8053-9592-1.
- Rosonina E., Kaneko S., Manley J. L. Terminating the transcript: breaking up is hard to do. (англ.) // Genes & Development. — 2006. — 1 May (vol. 20, no. 9). — P. 1050—1056. — doi:10.1101/gad.1431606. — PMID 16651651.
- Luo W., Bentley D. A ribonucleolytic rat torpedoes RNA polymerase II. (англ.) // Cell. — 2004. — 29 December (vol. 119, no. 7). — P. 911—914. — doi:10.1016/j.cell.2004.11.041. — PMID 15620350.
- Luo W., Johnson A. W., Bentley D. L. The role of Rat1 in coupling mRNA 3'-end processing to transcription termination: implications for a unified allosteric-torpedo model. (англ.) // Genes & Development. — 2006. — 15 April (vol. 20, no. 8). — P. 954—965. — doi:10.1101/gad.1409106. — PMID 16598041.