Рибопереключатель
Рибопереключа́тель[1] (англ. riboswitch) — элемент 5'-нетранслируемой области (5'-НТО) мРНК. Он осуществляет цис-регуляцию мРНК, на которой находится, путём связывания с лигандами — разнообразными малыми молекулами, например, кобамамидом, тиаминпирофосфатом, лизином, глицином, флавинмононуклеотидом, гуанином, аденином и другими. Типичный рибопереключатель включает два основных домена: аптамерный домен, осуществляющий распознавание лиганда и связывание с ним, и платформу экспрессии (англ. expression platform), которая взаимодействует с белками транскрипции или трансляции. Аптамерный домен и платформа экспрессии перекрываются в области так называемой переключающей последовательности, которая и отвечает за сворачивание РНК в две взаимноисключающие вторичные структуры, за счёт чего и осуществляется регуляция.
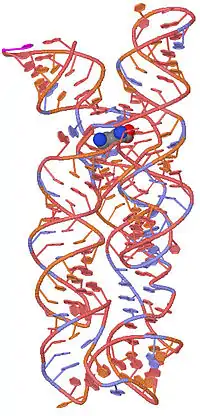
Рибопереключатели выявлены у представителей всех трёх доменов жизни, а также некоторых вирусов[2][3].
История изучения
Многие бактерии могут или транспортировать необходимые малые молекулы из окружающей среды, или синтезировать их самостоятельно из простых предшественников. Для каждого из этих процессов требуется особый набор белков, и бактерии часто используют механизм обратной связи для контроля продуктами предшествующих ферментативных стадий: избыток необходимого продукта или подавляет свой собственный синтез, или активирует последующие ферментативные стадии. Обычно уровень клеточных метаболитов отслеживается специальными белками, которые взаимодействуют с ДНК или РНК, регулируя синтез соответствующих ферментов. По этой причине, когда открыли подавление генов биосинтеза витаминов B1, B2 и B12 такими соединениями, как тиамин, рибофлавин и кобаламин соответственно, основные усилия были направлены на поиск соответствующих белков-репрессоров, отслеживающих уровень этих соединений. Однако такие гипотетические модуляторы не были найдены. Эти результаты заставили обратить внимание на возможную регуляторную роль консервативных последовательностей мРНК («боксов») и сделать смелое предположение, что, возможно, уровень этих производных витаминов отслеживается непосредственно РНК. Кроме того, в 1998 году Grundy и Henkin[4] показали, что лидерная область мРНК cob Salmonella typhimurium имеет значительно различающиеся конформации в присутствии и в отсутствие аденозилкобаламина (AdoCbl). Однако попытки непосредственно проверить связывание кобаламина с мРНК не увенчались успехом. Схожие результаты были получены с мРНК btuB Escherichia coli: добавление AdoCbl заставляло обратную транскриптазу остановиться вблизи 3'-конца лидерного участка мРНК в ходе in vitro удлинения праймеров, что, судя по всему, говорит о стабилизации этого участка при связывании с метаболитом[5].
В конце концов, было показано, что три производных витаминов — тиаминпирофосфат (ТРР), флавинмононуклеотид (FMN) и AdoCbl — непосредственно взаимодействуют с соответствующими мРНК, контролируя опероны витаминов B1, B2 и B12. Эти сообщения показали, что связывание метаболитов стабилизирует конформацию эволюционно консервативного РНК-сенсора (природного аптамера) и индуцирует укладку неконсервативных нижележащих областей РНК в такую структуру, которая влияет на терминацию транскрипции или инициацию трансляции. Таким образом, непосредственное связывание метаболита с РНК вызывает «рибопереключение» мРНК между альтернативными конформациями, влияя на экспрессию генов[5]. Термин «рибопереключатель» (англ. riboswitch) был предложен в 2002 году Breaker и коллегами[4].
Регуляторные механизмы
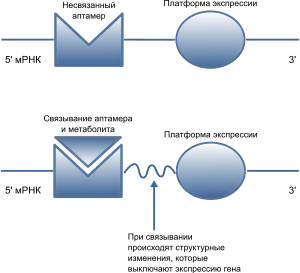
После открытия первых рибопереключателей, специфичным к витаминам, было открыто множество других типов рибопереключателей. К настоящему моменту установлено, что рибопереключатели могут реагировать на пурины и их производные, коферменты белков и родственные соединения, аминокислоты и фосфорилированные сахара. Некоторые рибопереключатели специфично реагируют на неорганические лиганды, в том числе металлы (ионы Mg2+), которые притягиваются к отрицательно заряженному сахарофосфатному остову РНК и к отрицательно заряженным анионам фтора[5].
Функционально и структурно в рибопереключателях можно выделить два домена. Первый из них — аптамерный домен — отвечает за связывание с лигандом и формирует лиганд-связывающий карман, подходящий для определённого лиганда. Второй домен, известный как платформа экспрессии, содержит переключательный элемент вторичной структуры, взаимодействующий с регуляторными белками транскрипции и трансляции. Аптамерный домен и платформа экспрессии перекрываются в области переключающей последовательности, которая и выполняет регуляторную функцию. Переключающая последовательность направляет смену двух взаимоисключающих структур платформы экспрессии, которые соответствуют «включённому» и «выключенному» состояниям мРНК[2].
Несмотря на огромное разнообразие лигандов рибопереключателей, регуляторная активность подавляющего большинства бактериальных рибопереключателей направлена на изменение транскрипции или трансляции генов, отвечающих за транспорт и синтез этого метаболита. Эта регуляторная активность основана на том, что в зависимости от присутствия лиганда РНК может принимать две взаимно исключающие конформации. В случае транскрипции такие структуры выступают в качестве Rho-независимых терминаторных или антитерминаторных шпилек. В случае трансляции перестройки, зависимые от лиганда, включают выставление наружу или упаковку внутрь сайтов связывания рибосомы (англ. riosome bnding site, RBS) или последовательности Шайна — Дальгарно (англ. Shine-Dalgarno sequence, SD). Недавние исследования показали, что рибопереключатели могут осуществлять Rho-зависимую терминацию транскрипции. Этот регуляторный механизм, по-видимому, широко распространён, так как у ряда рибопереключателей отсутствуют Rho-независимые терминаторы или шпильки, убирающие RBS или SD внутрь молекулы[5].
Необычный способ регуляции использует рибопереключатель-рибозим glmS, который обеспечивает разрезание мРНК после связывания с метаболитом. Эта некодирующая РНК, как правило, имеется у грамположительных бактерий и взаимодействует с глюкозамин-6-фосфатом (GlcN6P), который после связывания с мРНК glmS разрезает её в районе рибопереключателя. После этого РНКаза J разрушает продукт разрезания, начиная с 5'-OH конца, тем самым предотвращая трансляцию мРНК glmS. Рибопереключатель-рибозим glmS разрушает традиционное представление о том, что рибопереключатель распознаёт только одно соединение: этот рибопереключатель может связываться с целым рядом родственных соединений, а потому может служить для оценки общего метаболического статуса клетки[5][4].
Некоторые рибопереключатели могут участвовать в различных регуляторных процессах. Циклический дигуанозил-5'-монофосфат (c-di-GMP), вторичный посредник, запускает ряд физиологических изменений, и соответствующие ему рибопереключатели располагаются рядом с генами, участвующими в обеспечении клеточной подвижности, вирулентности и других процессов. Некоторые рибопереключатели, работающие с c-di-GMP, располагаются рядом с самосплайсирующимися интронами I группы. Эти РНК-регуляторы функционируют за счёт сложного каскада событий, требующих участия обоих регуляторных участков РНК. c-di-GMP связывается со своим аптамером и индуцируют изменение его укладки, которое позволяет GTP атаковать 5'-конец интрона. В результате интрон вырезается, и удалённые друг от друга участки RBS сближаются, формируя мРНК, способную к трансляции. Такое объединённое аллостерическое взаимодействие двух участков РНК даёт систему с двумя точками контроля, которая распознаёт концентрации и c-di-GMP, и GTP, и запускает сплайсинг. Эта гипотеза требует экспериментального подтверждения[5].
После открытия рибопереключателей было высказано предположение, что эти типичные цис-регуляторные элементы могут выступать и в роли транс-регуляторных элементов. Судя по всему, это верно по крайней мере для S-аденозилметиониновых (SAM) рибопереключателей SreA и SreB Listeria monocytogenes. После SAM-зависимой терминации транскрипции эти рибопереключатели комплементарно связываются с 5'-нетранслируемой областью (5'-UTR) мРНК, кодирующей фактор вирулентности PrfA, и подавляют его экспрессию на уровне трансляции[5].
У эукариот разобщение транскрипции и трансляции, а также наличие интронов требует участия различных механизмов регуляции экспрессии генов. Эукариотические тиаминпирофосфатные (ТРР) рибопереключатели влияют не на транскрипцию и/или трансляцию, а на альтернативный сплайсинг. «Нормальный» сплайсинг происходит тогда, когда участок внутри рибопереключателя, расположенного в межгенном участке или 3'-НТО, комплементарно спаривается с участком, перекрывающим один из сайтов сплайсинга. Это происходит в отсутствие ТРР. Получающийся после сплайсинга продукт транслируется в полноценный белок. Когда ТРР присутствует в клетке в пороговой концентрации, он связывается с рибопереключателем, в результате чего доселе скрытый сайт сплайсинга выходит на поверхность и становится доступным для аппарата сплайсинга. В зависимости от вида альтернативно сплайсированная мРНК содержит внутренние стоп-кодоны, которые или приводят к трансляции неправильного пептида (нитчатые грибы), или к преждевременной терминации трансляции (зелёные водоросли). У высших растений результатом альтернативного сплайсинга являются транскрипты со слишком длинными 3'-НТО, которые их дестабилизируют[5]. Иногда рибопереключатели могут осуществлять регуляцию и на уровне транскрипции, и на уровне трансляции. Рибопереключатель SAM-I в ответ на изменение концентрации серы откликается образованием антисмысловой РНК, но детали процесса регуляции всё ещё неизвестны[4].
Хотя достоверно описанные эукариотические рибопереключатели относятся только к ТРР-зависимым системам, недавнее исследование показало наличие аденозин-связывающих РНК-аптамеров в геномах позвоночных. Биологическая роль этих РНК ещё изучается. Некоторые эукариотические мРНК могут отвечать на изменения окружающей среды, меняя одну из альтернативных конформаций на другую, подобно рибопереключателям. Например, в ответ на сигналы от интерферона-γ и гипоксии в 3'-НТО мРНК фактора роста сосудистого эндотелия-А (VEGF) происходит РНК-переключение, влияющее на трансляцию VEGF в миелоидных клетках. Однако изменение конформации в этом случае связано не с метаболитом, а с связыванием с белками в ответ на внешний стимул[5].
Рибопереключатели не всегда функционируют как одиночные регуляторные единицы. Два сенсорных домена или целые рибопереключатели (в случае так называемых тандемных рибопереключателей) иногда располагаются по соседству. Например, многие глициновые рибопереключатели состоят из двух сенсоров глицина, разделённых короткой линкерной вставкой, и могут принимать очень сложную третичную структуру. Даже несмотря на то что два сенсорных домена могут помогать друг другу в фолдинге и связывании с лигандом, биологическая цель такой дупликации ещё не установлена однозначно. Биологическая роль тандемных рибопереключателей с разными специфичностями более ясна. Они модулируют экспрессию генов только тогда, когда в клетке имеются все необходимые метаболиты. Опосредованные рибопереключателями регуляторные пути могут быть включены в другие, ещё более сложные системы регуляции экспрессии генов. Например, SAM-рибопереключатели L. monocytogenes функционируют только при температурах, пермессивных для инфекции, когда расположенный по соседству РНК-термометр меняет свою конформацию и расплавляется. Другой пример — использование этаноламина Enteroccus faecalis, при котором рибопереключатель AdoCbl действует совместно с белком-регулятором, который влияет на стабильность терминаторов транскрипции[5].
Архитектура
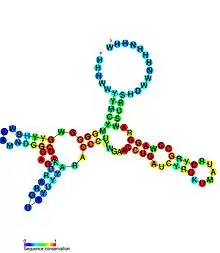
Исключительная селективность рибопереключателей целиком обусловлена консервативностью их доменов-сенсоров. Сайты распознавания лиганда значительно варьруют по размеру и сложности вторичной и третичной структур. Для всех главных классов рибопереключателей, а также некоторых подклассов были получены структуры сенсорных доменов в комплексе с соответствующими лигандами были получены структуры с высоким разрешением. Несмотря на то что рибопереключатели имеют очень непохожие конформации (только близкородственные пуриновые рибопереключатели обнаруживают некоторое сходство), структура большей части рибопереключателей содержит соединения многих спиралей и псевдоузлы, как у рибозимов. По этой причине большую часть рибопереключателей можно разделить на два типа в зависимости от структуры: к первому типу относятся рибопереключатели, чья структура представлена соединениями нескольких спиралей («соединительные» рибопереключатели), а ко второму — рибопереключатели с псевдоузлами в структуре[5].
«Соединительные» рибопереключатели можно разделить на два подтипа в зависимости от расположения ключевого соединения, в котором участвует регуляторная спираль Р1. Она прикрывает домен-сенсор и, как правило, содержит участок, дающий ей возможность соединяться с разными структурными элементами. В рибопереключателях типа Ia мультиспиральное соединение занимает центральное положение и соединяет остальные спирали со спиралью Р1, которая, как правило, принимает участие во множестве взаимодействий, стабилизирующих третичную структуру молекулы. Так происходит в пуриновых и ТРР-рибопереключателях. Одна из спиралей может быть значительно длиннее других и способна отгибаться к мультиспиральному соединению, где образует третичные взаимодействия; таким образом устроен лизиновый рибопереключатель — один из самых крупных описанных рибопереключателей[2]. Метаболит-связывающие карманы формируются внутри мультиспирального соединения или рядом с ним, так что связывание РНК с лигандом непосредственно отражается на стабильности всего мультиспирального соединения и спирали Р1[5].
Рибопереключатели второго типа (Ib) характеризуются «обратной» архитектурой соединений, при котором ключевое мультиспиральное соединение отнесено на периферию молекулы и находится далеко от спирали Р1. Спираль, исходящая из соединения, отгибается к Р1 и стабилизирует её через длиннодействующие третичные взаимодействия. Метаболиты связываются с РНК в участке соединения и/или неподалёку от Р1, влияя на её формирование через стабилизацию общей конформации и третичных взаимодействий. Типичными представителями класса Ib являются тетрагидрофолатный (THF) и магниевый рибопереключатели[5].
К подтипу II относятся такие рибопереключатели, как SAM-II- и фторидный рибопереключатели, чьи структуры целиком представлены небольшими псевдоузлами. Стоит подчеркнуть, что псевдоузлы — это важные части некоторых «соединительных» рибопереключателей, они могут участвовать в формировании метаболит-связывающих карманов, как в случае рибопереключателя-рибозима glmS, а также формировании длиннодействуюзих третичных связей, как у рибопереключателя SAM-I[5].
Становится понятным, что структура рибопереключателя и лиганда не связаны друг с другом. Более того, в трёх классах рибопереключателей, распознающих SAM, имеются различные соединительные структурные элементы и псевдоузлы. К числу часто имеющихся у рибопереключателей структурных элементов можно отнести, помимо спиралей и псевдоузлов, K-повороты (англ. kink turn, K turn), взаимодействия kissing-loop, петли sarcin-ricin и T-петли[2]. Это показывает удивительную способность РНК принимать различные конфигурации для распознавания одного и того же лиганда. Стоит отметить, что многие рибопереключатели содержат повторяющиеся структурные мотивы, которые присутствуют в других природных и искусственных РНК. Как и другие функциональные РНК, рибопереключатели используют эти мотивы как основные строительные блоки для построения сложных пространственных структур[5].
Распознавание лигандов
Рибопереключатели способны распознавать лиганды самой различной химической природы и не разделяют какой-либо общей особенности, позволяющей им связываться с метаболитами. Тем не менее, в связывании лигандов рибопереключателями есть ряд общих черт. Большинство рибопереключателей формируют жёсткие карманы для связывания, которые безупречно подходят для связывания участков структур распознаваемых лигандов, а небольшие лиганды целиком размещаются в таких карманах. Связывание с лигандом вызывают структурные изменения в рибопереключателях[2]. Карманы, как правило, окружены консервативными нуклеотидами и неканоническими парами оснований, располагающимися на расширенной неправильной спирали или сходящихся спиралях. За несколькими исключениями, большинство лигандов используют гетероатомы для формирования специфических водородных связей и электростатических взаимодействий с РНК. Часто специфические водородные связи образуются между концами лигандов и консервативными неспаренными нуклеотидами РНК (например, G40 в аминопуриновом сенсоре). Плоскостные группы лигандов, как правило, участвуют в стэкинг-взаимодействиях и зажаты между пуринами РНК. Ионы металлов, такие как Mg2+ и К+, могут компенсировать отрицательный заряд лиганда или его функциональных групп, таких как фторидные, карбоксильные и фосфатные остатки. Ионы металлов также задействованы во взаимодействиях лиганд-РНК через непосредственную координацию или координацию, опосредованную водой. Все эти свойства были продемонстрированы в комплексах рибопереключателей и их правильных лигандов с использованием рентгеноструктурного анализа рибопереключателей, не связанных с лигандами, а также рибопереключателями, связанных с правильными лигандами или лигандами, очень похожими на правильные. Эти исследования позволили заключить, что рибопереключатели связываются со своими правильными лигандами, используя комбинацию «конформационного отбора» и механизмов индуцированной формы. Рибопереключатели отличают похожие соединения в основном за счёт пространственных несоответствий, а также формирования специфических взаимодействий. Большинство рибопереключателей в высшей степени специфичны. Например, разница в связывании пуринового рибопереключателя с аденином и гуанином достигает 10000 раз, а лизиновый рибопереключатель распознаёт очень близкие по структуре аминокислоты лизин и орнитин с разницей 5000 раз[2]. Интересно, что рибопереключатели одного класса могут быть нацелены на распознавание различных концентраций одного и того же метаболита. Они могут также различаться по термодинамическим и кинетическим параметрам, иными словами, они могут различаться наличием равновесия между РНК и естественным лигандом[5].
Происхождение
Происхождение и эволюция рибопереключателей — одна из наиболее интригующих проблем в изучении РНК. Эксперименты in vitro показали, что РНК может подстроиться под связывание лиганда относительно легко, поэтому естественному отбору нужно сравнительно немного времени, чтобы превратить последовательности РНК в метаболит-связывающие домены. Малораспространённые рибопереключатели могли появиться в ходе эволюции поздно. Несколько таких событий могли дать начало независимым классам рибопереключателей, специфичных по отношению к одному и тому же соединению, например, SAM. В то же время наличие ТРР-рибопереключателей во всех трёх доменах жизни свидетельствует о древнем происхождении этого типа рибопереключателей и их устойчивости к эволюционному давлению. Согласно гипотезе мира РНК, в некоторый момент РНК выступала как носителем генетической информации, так и катализатором химических реакций. Каталитическая способность рибопереключателя-рибозима glmS, а также способность рибопереключателей взаимодействовать с «древними» коферментами, такими как FMN, TPP и SAM, которые, вероятно, были широко распространены в самых ранних биохимических реакциях, заставляют предположить, что молекулы, подобные рибопереключателям, были инструментами, обеспечивающими существование и эволюцию первичного мира РНК. Вполне вероятно, что рибопереключатели выступали регуляторными элементами мира РНК. Рибопереключатели сохранились до сегодняшнего дня, возможно, благодаря тому, что они заняли нишу метаболической регуляции, которая более подходит для РНК, чем для белков. В то же время, регуляция с помощью рибопереключателей более энергозатратная, так как для её осуществления необходимо, чтобы была синтезирована мРНК регулируемого гена. При этом регуляция с помощью рибопереключателей требует меньше промежуточных этапов, чем регуляция с помощью специальных белков[5][2].
Применение
На основании принципов работы рибопереключателей разрабатываются новые, искусственные генетические переключатели. Например, можно модифицировать аптамер и получить новый контролирующий элемент, распознающий нужные исследователю вещества. Был разработан искусственный рибопереключатель, который не только распознаёт необходимый элемент, но и разрезает сам себя, то есть обладающий рибозимной активностью. Этот конструкт получил название «аптазим», он может найти применение в медицине для саморазрезания вирусных мРНК в клетке и, соответственно, подавления экспрессии генов вируса[6]. Рибопереключатели могут также найти применение в генной терапии[7]. Кроме того, рибопереключатели могут быть очень полезными в изучении биологии бактерий, например, как инструмент для создания искусственных механизмов экспрессии генов[8][9]. Другое направление развития искусственных рибозимов — создание биосенсоров, которые в ответ на связывание с лигандами испускают какой-нибудь детектируемый результат, например, электрохимический сигнал или флуоресценцию[4][10]. Разработаны флуоресцирующие рибопереключатели, которые позволяют визуализировать изменения концентраций метаболитов в бактериальных клетках[11].
В 2016 году было сообщено о создании «термопереключателей» — интеграции температурочувствительных РНК-термометров и аптамеров рибопереключателей в единую структуру. Термопереключатели функционируют как рибопереключатели при низких температурах и реагируют на связывание со своим лигандом изменением структуры, а при высокой температуре они переходят в постоянно «включённое» состояние. Подобные искусственные РНК-регуляторы могут широко применяться для регуляции экспрессии генов[4].
Рибопереключатели рассматриваются как перспективная мишень для разработки новых антибиотиков. Например, вещество розеофлавин связывается непосредственно с аптамером FMN-рибопереключателя, подавляя экспрессию соответствующего гена у Bacillus subtilis. Аналогичным образом аминоэтилцистеин подавляет рост некоторых грамположительных бактерий, связываясь с лизиновым рибопереключателем. Однако антимикробная активность вышеназванных соединений сводится на нет при мутациях в соответствующих рибопереключателях[4]. Существуют рибопереключатели, которые обеспечивают резистентность к антибиотикам. Так, аминогликозидный рибопереключатель располагается на мРНК ферментов аминогликозидацетилтрансферазы и аминогликозиднуклеотидилтрансферазы, обеспечивающих устойчивость к аминогликозидным антибиотикам. При связывании с аминогликозидом рибопереключатель включает транскрипцию этих ферментов, обеспечивая резистентность к аминогликозидным антибиотикам[12].
Примечания
- Спирин, 2011, с. 386.
- Garst A. D., Edwards A. L., Batey R. T. Riboswitches: structures and mechanisms. (англ.) // Cold Spring Harbor perspectives in biology. — 2011. — Vol. 3, no. 6. — doi:10.1101/cshperspect.a003533. — PMID 20943759.
- Vieweger M., Holmstrom E. D., Nesbitt D. J. Single-Molecule FRET Reveals Three Conformations for the TLS Domain of Brome Mosaic Virus Genome. (англ.) // Biophysical journal. — 2015. — Vol. 109, no. 12. — P. 2625—2636. — doi:10.1016/j.bpj.2015.10.006. — PMID 26682819.
- Mehdizadeh Aghdam E., Hejazi M. S., Barzegar A. Riboswitches: From living biosensors to novel targets of antibiotics. (англ.) // Gene. — 2016. — Vol. 592, no. 2. — P. 244—259. — doi:10.1016/j.gene.2016.07.035. — PMID 27432066.
- Serganov A., Nudler E. A decade of riboswitches. (англ.) // Cell. — 2013. — Vol. 152, no. 1-2. — P. 17—24. — doi:10.1016/j.cell.2012.12.024. — PMID 23332744.
- Ketzer P., Kaufmann J. K., Engelhardt S., Bossow S., von Kalle C., Hartig J. S., Ungerechts G., Nettelbeck D. M. Artificial riboswitches for gene expression and replication control of DNA and RNA viruses. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2014. — Vol. 111, no. 5. — P. 554—562. — doi:10.1073/pnas.1318563111. — PMID 24449891.
- Strobel B., Klauser B., Hartig J. S., Lamla T., Gantner F., Kreuz S. Riboswitch-mediated Attenuation of Transgene Cytotoxicity Increases Adeno-associated Virus Vector Yields in HEK-293 Cells. (англ.) // Molecular therapy : the journal of the American Society of Gene Therapy. — 2015. — Vol. 23, no. 10. — P. 1582—1591. — doi:10.1038/mt.2015.123. — PMID 26137851.
- Robinson C. J., Medina-Stacey D., Wu M. C., Vincent H. A., Micklefield J. Rewiring Riboswitches to Create New Genetic Circuits in Bacteria. (англ.) // Methods in enzymology. — 2016. — Vol. 575. — P. 319—348. — doi:10.1016/bs.mie.2016.02.022. — PMID 27417935.
- Ohbayashi R., Akai H., Yoshikawa H., Hess W. R., Watanabe S. A tightly inducible riboswitch system in Synechocystis sp. PCC 6803. (англ.) // The Journal of general and applied microbiology. — 2016. — Vol. 62, no. 3. — P. 154—159. — doi:10.2323/jgam.2016.02.002. — PMID 27250662.
- Ketterer S., Gladis L., Kozica A., Meier M. Engineering and characterization of fluorogenic glycine riboswitches. (англ.) // Nucleic acids research. — 2016. — Vol. 44, no. 12. — P. 5983—5992. — doi:10.1093/nar/gkw465. — PMID 27220466.
- Litke J. L., You M., Jaffrey S. R. Developing Fluorogenic Riboswitches for Imaging Metabolite Concentration Dynamics in Bacterial Cells. (англ.) // Methods in enzymology. — 2016. — Vol. 572. — P. 315—333. — doi:10.1016/bs.mie.2016.03.021. — PMID 27241761.
- Chen D., Murchie A. I. An aminoglycoside sensing riboswitch controls the expression of aminoglycoside resistance acetyltransferase and adenyltransferases. (англ.) // Biochimica et biophysica acta. — 2014. — Vol. 1839, no. 10. — P. 951—958. — doi:10.1016/j.bbagrm.2014.02.019. — PMID 24631585.
Литература
- Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка. — М.: Издательский центр «Академия», 2011. — 496 с. — ISBN 978-5-7695-6668-4.
Ссылки
- Чугунов, Антон. Фолдинг «воочию». // Сайт Biomolecula.ru (18.02.2008). Дата обращения: 20 марта 2018.
- Еникеев, Александр. Биоинформатика в мире РНК-структур. // Сайт Biomolecula.ru (25.11.2014). Дата обращения: 20 марта 2018.