Гексацианоферрат(II) калия
Гексацианоферра́т(II) ка́лия (железистосинеро́дистый ка́лий, ферроциани́д ка́лия, гексацианоферроа́т ка́лия, жёлтая кровяная соль) — неорганическое соединение из группы гексацианоферратов, комплексная соль состава , содержащая в анионе двухвалентное железо, выделяющаяся из водного раствора в виде кристаллогидрата .
| Гексацианоферрат(II) калия | |||
|---|---|---|---|
 | |||
| |||
| Общие | |||
| Систематическое наименование |
Гексацианоферрат(II) калия | ||
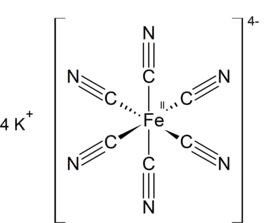
| Хим. формула | C6N6FeK4 | ||
| Рац. формула | K4[Fe(CN)6] | ||
| Физические свойства | |||
| Состояние | безводный — бесцветные кристаллы, тригидрат — бледно-жёлтые кристаллы | ||
| Молярная масса | 368,35 г/моль | ||
| Плотность | тригидрата 1,85 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | +69…+71 °C | ||
| • разложения | ~650 °C | ||
| Классификация | |||
| Рег. номер CAS | 13943-58-3 | ||
| PubChem | 9605257 | ||
| Рег. номер EINECS | 237-722-2 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E536 | ||
| ChEBI | 30059 | ||
| ChemSpider | 20162028 | ||
| Безопасность | |||
| Краткие характер. опасности (H) |
H412, EUH032 |
||
| Меры предостор. (P) |
P273, P260 |
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
История открытия
В 1752 году Макер обнаружил, что при кипячении берлинской лазури с раствором щёлочи (едкого кали) синий цвет её исчезает, а в раствор переходит желтое вещество. Исследования Бертолле (1787), Гей-Люссака и Берцелиуса (1819) показали, что вещество это содержит калий, железо (II) и остаток синильной кислоты; сначала его принимали за двойную соль. Впоследствии, усилиями Гмелина, Гей-Люссака и Либиха выяснилось, что это калиевая соль железистосинеродистой кислоты[1].
Названия
Помимо «жёлтой кровяной соли», в ЭСБЕ отмечены также следующие тривиальные названия[1]:
- жёлтое синь-кали,
- жёлтая соль,
- кровещелочная соль.
Название «жёлтая кровяная соль» появилось из-за того, что раньше её получали прокаливанием отходов боен (содержащих кровь) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения[2].
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит в белый осадок гексацианоферрата(II) железа(II):
(а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого осадка со щёлочью: )[2].
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Физические и химические свойства
Светло-жёлтые кристаллы с тетрагональной (существуют также ромбическая и моноклинная модификации) решёткой, существующие в виде тригидрата [3]. Плотность 1,853 г/см³ при +17 °C.
Растворимость в воде 35,8 г/100 г при +25 °C, она уменьшается в присутствии аммиака или других солей калия. В абсолютном спирте нерастворим, но растворяется в смесях спирта с водой. Мало растворим в метаноле (0,024 моль/л), практически не растворяется в эфире, пиридине, анилине, этилацетате, жидких хлоре и аммиаке[3].
Гексацианоферрат(II) калия диамагнитен, при низких температурах является сегнетоэлектриком[3].
Выше +120 °C (по другим данным, выше +87,3 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается[2]:
В реакции с концентрированной соляной кислотой выделяется белый осадок железистосинеродистой кислоты ()[2].
С концентрированной серной кислотой реагирует по уравнению:
- .
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) .
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до гексацианоферрата(III) калия:
Анион очень прочен (его константа нестойкости, по разным данным[2][4], от 4⋅10-36 до 1⋅10-35), не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому с «традиционными» реагентами растворы гексацианоферратов(II) не дают реакций ни на , ни на [2]. Однако диссоциативно разрушить этот комплекс и обнаружить в нём наличие двухвалентного железа, всё-таки, удаётся, одновременно связав и железо, и цианид в отдельные прочные комплексы; например, обработав раствор гексацианоферрата(II) смесью α,α'-дипиридила и хлорида ртути. При этом появляется красное окрашивание вследствие образования комплекса с α,α'-дипиридилом при одновременном связывании цианида в виде [5].
Токсичность
Нейтральное вещество, поскольку анион (см. выше) не разлагается в воде и внутри человеческого организма. Летальная доза (LD50) для крыс при приёме перорально составляет 6400 мг/кг[6].
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли. В Российской Федерации широко применяют при производстве продуктов питания — соли, творожных продуктов, в виноделии и прочем.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. : образуется малорастворимый синий осадок «берлинской лазури»:
- ,
или, в ионной форме
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. : образуется белый осадок гексацианоферрата(II) цинка-калия[7]:
- ,
или, в ионной форме
3. : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
- ,
или, в ионной форме
Может использоваться для получения синильной кислоты:
Мнемоническое правило
Для того, чтобы запомнить формулу жёлтой кровяной соли и не спутать её с красной кровяной солью существуют мнемонические правила:
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — жёлтая кровяная соль . «Red» — 3 буквы, то есть 3 атома калия — красная кровяная соль — .
Примечания
- Желтая или кровещелочная соль // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Некрасов Б.В. Основы общей химии. — М., 1973. — Т. 2. — С. 360.
- Тананаев, 1971, с. 38-39.
- Тананаев, 1971, с. 5.
- Ф. Файгль, В.Ангер. Капельный анализ неорганических веществ. — 1976. — Т. 1. — С. 242.
- POTASSIUM FERROCYANIDE. hazard.com. Дата обращения: 16 января 2016.
- Аналитические методы определения цинка
Литература
- Тананаев И.В. и др. Химия ферроцианидов. — М., 1971.


