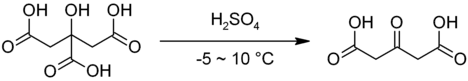Ацетондикарбоновая кислота
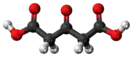
Ацетондикарбоновая кислота (β-кетоглутаровая кислота) — двухосновная кетокислота, бесцветные кристаллы, медленно разлагающиеся при комнатной температуре. Хорошо растворима воде и этаноле, при нагревании — в этилацетате, плохо растворима в эфире и хлороформе.
| Ацетондикарбоновая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
3-оксопентандиовая кислота | ||
| Традиционные названия | ацетондикарбоновая кислота, β-кетоглутаровая кислота, 3-кетоглутаровая кислота, 3-оксоглутаровая кислота | ||
| Хим. формула | C5H6O5 | ||
| Рац. формула | HOOC-CH2(C=O)CH2COOH | ||
| Физические свойства | |||
| Состояние | бесцветные игольчатые кристаллы | ||
| Молярная масса | 146,09814 г/моль | ||
| Плотность | 1,499 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 122 (разл.) | ||
| Классификация | |||
| Рег. номер CAS | 542-05-2 | ||
| PubChem | 68328 | ||
| Рег. номер EINECS | 208-797-9 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 88950 | ||
| ChemSpider | 61623 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ацетондикарбоновая кислота и её производные широко применяются в синтезе, в том числе синтезе алкалоидов и других природных соединений.
Синтез
Стандартный лабораторный метод синтеза ацетондикарбоновой кислоты — декарбонилирование лимонной кислоты олеумом:
Реакцию проводят на холоду (0 — 10 °C) и под тягой, так как в ходе реакции выделяется токсичный монооксид углерода; выход неочищенной кислоты, пригодной для дальнейшей этерификации, составляет 85-90 %, при необходимости продукт может быть очищен перекристаллизацией из этилацетата[1].
Ацетондикарбоновая кислота может также быть синтезирована из ацетона — прямым карбоксилированием диоксидом углерода или в три стадии через 1,3-дихлорацетон с дальнейшим замещением хлора цианидом и гидролизом в мягких условиях образовавшегося 1,3-дицианоацетона, однако эти методы ввиду их сложности на практике не используются[2].
Реакционная способность и применение в синтезе
По своим химическим свойствам ацетондикарбоновая кислота является типичным представителем β-кетокислот: её реакционная способность определяется, во-первых, наличием двух электронакцепторных заместителей — карбонильной и карбоксильной — у метиленовых групп, что обуславливает их нуклеофильность и кислотность и, во вторых, возможностью образования шестичленного цикла, в котором протон карбоксильной группы образует водородную связь с кислородом кетогруппы.
Сочетание этих свойств обуславливает легкость декарбоксилирования ацетондикарбоновой кислоты, которое происходит уже при комнатной температуре, эта реакция, как и в случае других β-кетокислот (например, ацетоуксусной кислоты), идет через образование циклического переходного состояния, при этом ацетондикарбоновая кислота декарбоксилируется сначала до ацетоуксусной кислоты, которая, отщепляя диоксид углерода, образует ацетон:
Реакции с участием метиленовых групп
Для ацетондикарбоновой кислоты, как и для других β-дикарбонильных соединений, также характерны реакции, обусловленные нуклеофильностью метиленовых групп.
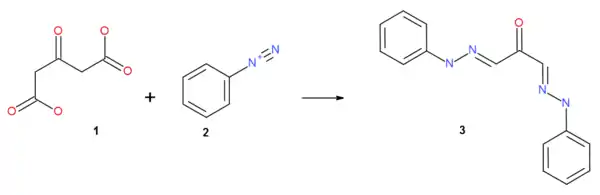
Так, ацетондикарбоновая кислота вступает в реакцию азосочетания с диазониевыми солями (2) с образованием бис-гидразонов мезоксалевого альдегида (3), при этом также происходит декарбоксилирование:
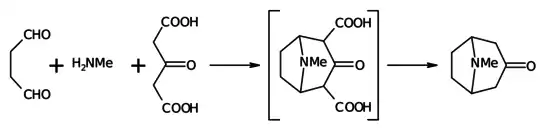
Ацетондикарбоновая кислота вступает в двойную конденсацию Манниха с диальдегидами и ароматическими аминами с образованием бициклических продуктов (Реакция Робинсона — Шёпфа), эта реакция используется как метод синтеза тропанов (в случае янтарного диальдегида)[3],[4] и псевдопельтьерина (при использовании глутарового альдегида)[5] и тоже сопровождается декарбоксилированием:
Аналогичная по механизму циклоконденсация эфиров ацетондикарбоновой кислоты с ароматическими альдегидами и аммиаком либо первичными аминами приводит к образованию пиперидонов[6],[7],[8]:

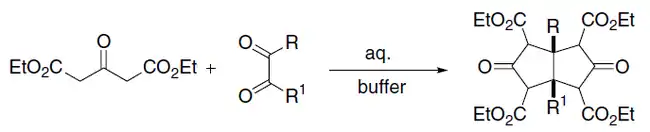
Эфиры ацетондикарбоновой кислоты вступают в конденсацию Кневенагеля с альдегидами, при этом образуются бис-продукты конденсации[9]; взаимодействие эфиров ацетондикарбоновой кислоты с α-дикарбонильными соединениями (реакция Вейса-Кука) приводит к образованию бицикло[3.3.0]октан-3,7-дионов[10]:
Эфиры ацетондикарбоновой кислоты, подобно ацетоуксусному эфиру и другим 1,3-дикарбонильным соединениям, легко алкилируются алкилгалогенидами в присутствии оснований, при этом соотношение продуктов C-алкилирования и O-алкилирования енолята зависит от условий проведения реакции[11].
Такое алкилирование эфиров ацетондикарбоновой кислоты α-галогенкарбонильными соединениями с вовлечением в реакцию карбонильной группы эфира используется в синтезе гетероциклических соединений.
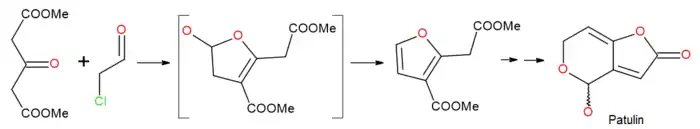
Так, в условиях реакции Фейста-Берари эфиры ацетондикарбоновой кислоты используются для синтеза фуранов, реакция диметилацетондикарбоксилата с хлорацетальдегидом, ведущая к 2,3-дизамещенному фурану, была использована в качестве первой стадии синтеза микотоксина патулина[12]:
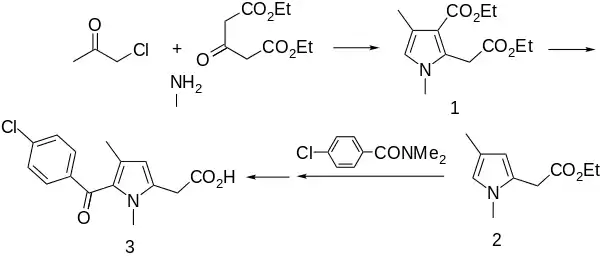
В сочетании с аминами или аммиаком фиры ацетондикарбоновой кислоты применятся в синтезе пирролов по Ганчу; взаимодействие с диэтилацетондикарбоксилата с хлорацетоном и метиламином является первой стадией синтеза противовоспалительного препарата зомепирака[13][14]:
Реакции с участием карбонильной группы
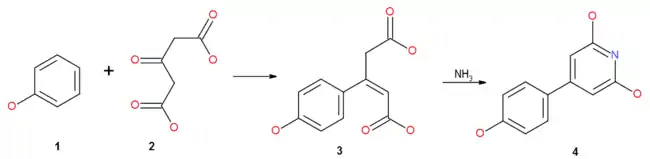
Ацетондикарбоновая кислота конденсируется с фенолами и их эфирами (2) с образованием β-замещенных производных глутаконовых кислот (3), которые служат исходными реагентами для синтеза 2,5-дигидроксипиридинов (4)[15]:
В условиях реакции образовавшиеся глутаконовые кислоты с гидроксильным заместителем в орто-положении ароматического кольца (3) могут замыкаться с образованием кумаринов (4)[16], в современных методиках синтеза используют ацетондикарбоновую кислоту, образующуюся in situ из лимонной кислоты при проведении конденсации в концентрированной серной кислоте[17],[18]:
Реакции с участием карбоксильных групп
Ацетондикарбоновая кислота этерифицируется спиртами при действии сухого хлороводорода, образуя диэфиры[19], моноэфиры ацетондикарбоновой кислоты получают ацилированием спиртов ангидридом ацетондикарбоновой кислоты.
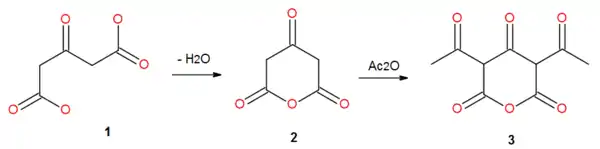
При дегидратации ацетондикарбоновой кислоты в уксусном ангидриде образуется её циклический ангидрид (1,2H-пиран-2,4,6(3H,5H)-трион), однако реакция осложняется идущим ацетилированием с образованием его моно- и диацетильных производных[20]:
В жестких условиях преобладающим продуктом становится дегидроацетовая кислота[21],[22].
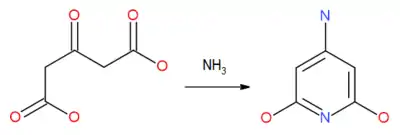
При взаимодействии эфиров ацетондикарбоновой кислоты с аммиаком происходит аммонолиз с образованием циклического имида и замещением кислорода карбонильной группы на иминогруппу, что приводит к образованию 4-амино-2,6-дигидроксипиридина (глутазина)[15]:
См. также
Примечания
- “ACETONEDICARBOXYLIC ACID”. Organic Syntheses. 5: 5. 1925. DOI:10.15227/orgsyn.005.0005. eISSN 2333-3553. ISSN 0078-6209. Дата обращения 2015-12-18.
- Eagleson, Mary. Concise Encyclopedia Chemistry. — Walter de Gruyter, 1994. — P. 6. — ISBN 978-3-11-011451-5.
- Robinson, Robert (1917-01-01). “LXIII.—A synthesis of tropinone”. J. Chem. Soc., Trans. 111 (0): 762—768. DOI:10.1039/CT9171100762. ISSN 0368-1645. Дата обращения 2015-12-16.
- C. Schöpf, Angew. Chem. 50, 779, 797 (1937)
- Menzies, Robert Charles; Robinson, Robert (1924-01-01). “CCLXXXVI.—A synthesis of ψ-pelletierine”. J. Chem. Soc., Trans. 125 (0): 2163—2168. DOI:10.1039/CT9242502163. ISSN 0368-1645. Дата обращения 2015-12-17.
- Petrenko-Kritschenko, P.; Zoneff, N. (1906-03). “Ueber die Condensation von Aceton-dicarbonsäureestern mit Benzaldehyd unter Anwendung von Ammoniak”. Berichte der deutschen chemischen Gesellschaft. 39 (2): 1358—1361. DOI:10.1002/cber.19060390234. eISSN 1099-0682. ISSN 0365-9496. Дата обращения 2015-12-21. Проверьте дату в
|date=(справка на английском) - P. Petrenko-Kritschenko et al., Ber. 41, 1692 (1908)
- P. Petrenko-Kritschenko et al., Ber. 42, 2020, 3683 (1909).
- Petrenko-Kritschenko, P.; Lewin, M. (1907-06). “Über die Kondensation der Aceton-dicarbonsäureester mit Aldehyden vermittels Ammoniak und Aminen”. Berichte der deutschen chemischen Gesellschaft. 40 (3): 2882—2885. DOI:10.1002/cber.19070400321. eISSN 1099-0682. ISSN 0365-9496. Дата обращения 2015-12-21. Проверьте дату в
|date=(справка на английском) - Weiss, U.; Edwards, J. M. (1968). “A one-step synthesis of ketonic compounds of the pentalane, [3,3,3]- and [4,3,3]-propellane series”. Tetrahedron Letters. 9 (47): 4885. DOI:10.1016/S0040-4039(00)72784-5.
- Zefirov, N. S.; Sadovaya, N. K.; Kombarova, S. V. (1988-06-20). “Alkylation of Methylenedimalonic and Acetonedicarboxylic Esters by Dihalogenoalkanes in the Presence of Potassium Carbonate in Dimethyl Sulfoxide”. J. Org. Chem. USSR (Engl. Transl.); (United States). 24:1. Дата обращения 2015-12-22.
- TADA, Masahiro; OHTSU, Kazuhisa; CHIBA, Kazuhiro (1994). “Synthesis of Patulin and Its Cyclohexane Analogue from Furan Derivatives”. Chemical & pharmaceutical bulletin. 42 (10): 2167—2169. ISSN 0009-2363. Дата обращения 2015-12-22.
- Carson, John R.; Wong, Stewart (1973). “5-Benzoyl-1-methylpyrrole-2-acetic acids as antiinflammatory agents. 2. 4-Methyl compounds”. Journal of Medicinal Chemistry. 16 (2): 172. DOI:10.1021/jm00260a023. PMID 4683116.
- J. R. Carson, DE 2102746; idem, US 3752826 (1971, 1973 both to McNeil).
- Klingsberg, E. The Chemistry of Heterocyclic Compounds, Pyridine and Its Derivatives. — John Wiley & Sons, 2009-09-15. — P. 512. — ISBN 978-0-470-18817-0.
- Dey, Biman Bihari (1915-01-01). “CLXXIX.—A study in the coumarin condensation”. Journal of the Chemical Society, Transactions. 107 (0): 1606—1651. DOI:10.1039/CT9150701606. ISSN 0368-1645. Дата обращения 2015-12-21.
- Liu, Xin; Wang, Hong; Liang, Shu-Cai; Zhang, Hua-Shan (2001-03). “4:3-β-naphthapyrone-4-acetic acidN-hydroxysuccinimidyl ester as a fluorescent labeling reagent for amino acids and oligopeptides in high-performance liquid chromatography”. Chromatographia. 53 (5–6): 326—330. DOI:10.1007/BF02490434. eISSN 1612-1112. ISSN 0009-5893. Дата обращения 2015-12-21. Проверьте дату в
|date=(справка на английском) - Cacic, Milan; Trkovnik, Mladen; Cacic, Frane; Has-Schon, Elizabeth (2006). “Synthesis and Antimicrobial Activity of Some Derivatives on the Basis (7-hydroxy-2-oxo-2H-chromen-4-yl)-acetic Acid Hydrazide”. Molecules. 11 (2): 134—147. Дата обращения 2015-12-21.
- “ETHYL ACETONEDICARBOXYLATE”. Organic Syntheses. 5: 53. 1925. DOI:10.15227/orgsyn.005.0053. eISSN 2333-3553. ISSN 0078-6209. Дата обращения 2015-12-18.
- Kiang, A. K.; Tan, S. F.; Wong, W. S. (1971). “Reactions of acetonedicarboxylic anhydride (tetrahydropyrantrione) and its mono- and di-acetyl derivatives with amines”. Journal of the Chemical Society C: Organic: 2721. DOI:10.1039/j39710002721. ISSN 0022-4952. Дата обращения 2015-12-18.
- von Pechmann and Neger, Ann., 273, 194 (1893)
- Kato, Tetsuzo; Kubota, Yukio (1966). “Structure of the Product from the Reaction of Acetonedicarboxylic Acid with Acetic Anhydride”. Pharmaceutical Bulletin. 14 (9): 931—933. DOI:10.1248/cpb.14.931. ISSN 0009-2363. Дата обращения 2015-12-18.