Имиды карбоновых кислот
Ими́ды карбо́новых кисло́т — соединения, содержащие группу -CO-NR-CO-, диацилпроизводные аммиака (R = H) или аминов[1]. Ациклические имиды — производные монокарбоновых кислот также называют диациламинами, большое значение в синтетической химии имеют циклические имиды дикарбоновых кислот.
Синтез
Ацилирование аммиака и аминов
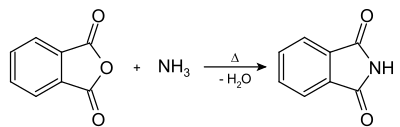
Ацилирование первичных аминов, аммиака или солей аммония является классическим и исторически первым методом синтеза циклических имидов из ангидридов двухосновных кислот. Так, реакция фталевого ангидрида с водным аммиаком ведет через образование аммонийной соли фталевой кислоты к фталимиду с выходом 95-97 %[2]:
Аналогично синтезируют и сукцинимид из янтарного ангидрида[3], и N-алкилфталимиды[4], и N-сукцинимиды[5]. Синтез проходит в достаточно жестких условиях, при температурах 100—200 °C на финальных стадиях.
Для ацилирования аминов ангидридами в более мягких условиях используют катализ кислотами Льюиса.
В качестве синтетических эквивалентов аммиака в синтезе циклических имидов могут использоваться формамид и мочевина.
Взаимодействие циклических ангидридов дикарбоновых кислот и самих кислот с формамидом в N-метил-2-пирролидоне приводит к образованию имидов, реакция идет с отщеплением муравьиной кислоты[6], в случае мочевины как синтетического аналога аммиака реакцию проводят в эвтектической смеси холинхлорида и мочевины[7].
Ацилирование амидов
Амиды монокарбоновых кислот могут быть ацилированы до имидов различными ацилирующими агентами — хлорангидридами и ангидридами карбоновых кислот:
- R1CONH2 + R2COX R1CONHCOR2 + HX
- R1CONHR2 + CH2=C(CH3)OCOR3 R1CONR2COR3
N-ацетоацетилкарбоксамиды могут быть синтезированы ацилированием амидов дикетеном в присутствии триметилсилилйодида, которые образуют in situ O-триметилсилильный эфир енола, который выступает в роли ацилирующего агента[9].
Из-за пониженной нуклеофильности амидного по сравнению с аминным азота прямое ацилирование амидов ангидридами карбоновых кислот идет в жестких условиях (катализ серной кислотой при нагреве[10]), однако использование эфирата бромида магния MgBr2•Et2O в качестве активатора позволяет проводить ацилирование в более мягких условиях[11].
Перегруппировка Мумма
Имиды образуются при перегруппировке изомерных им ацилимидатов (изоамидов):
Исходные ацилимидаты могут быть синтезированы различными методами — в частности, ацилированием серебряных солей карбоновых кислот имидоилхлоридами[12] и через взаимодействие нитрилилидов, образованных in situ из нитрилов и диазосоединений с карбоновыми кислотами[13].
Окисление N-алкиламидов
Имиды могут быть синтезированы окислением N-алкил и N-бензиламидов различными окисляющими агентами:
- R1CONHCH2R2 R1CONHCOR2
Окисление может проводиться пероксимоносульфатом калия в присутствии бромида калия и при облучении светом, предполагается, что реакция проходит по радикальному механизму с фотохимическим образованием радикалов брома из Br2, обращзующегося при окислении бромида[14].
Реакционная способность и химические свойства
Свойства и реакционная способность имидов сходны со свойствами амидов карбоновых кислот. Индуктивный эффект двух ацильных заместителей при атоме азота обуславливает большую кислотность атома водорода NH-группы, снижает нуклеофильность атомов азота и карбонильного кислорода, а также повышает электрофильность карбонильных атомов углерода ацильных групп по сравнению с амидами.
Реакции NH-группы
Имиды образуют соли со щелочными металлами, стабильные в спиртовых растворах, и которые легко алкилируются по атому азота алкилгалогенидами. Алкилирование калиевой соли фталимида алкилгалогенидами с последующим гидролизом образовавшегося N-алкилфталимида является классическим методом синтеза первичных аминов по Габриелю:
Имиды взаимодействуют с альдегидами и кетонами с образованием соответствующих аминокарбинолов:
- R'CONHCOR'' + R'''CHO R’CON(CHR'''OH)COR'
и в присутствии аминов вступают с ними в реакцию Манниха в качестве «кислотных» компонент:
- R’CONHCOR'' + CH2O + (CH3)2NH R'CON(CH2N(CH3)2)COR'
Имиды, подобно амидам, взаимодействуют с галогенами или гипогалогенитами с образованием N-галогенимидов, более стабильных, чем N-галогенамиды. Наиболее стабильны циклические N-галогенимиды, некоторые из которых (например, N-бромсукцинимид) используются в органическом синтезе в качестве источников галогена.
Циклические N-галогенимиды под действием оснований претерпевают перегруппировку Гофмана с образованием изоцианатов. Так, например, реакция фталимида с гипохлоритом в щелочной среде является промышленным методом синтеза антраниловой кислоты:
Реакции по карбонильной группе
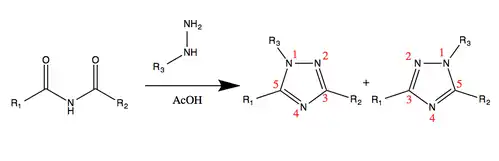
Органические имиды широко применяют в синтезе, аминов, аминокислот, пептидов, гетероциклических соединений, например, в синтезе триазолов по Эйнхорну-Бруннеру:
Примечания
- imides // IUPAC Gold Book
- “PHTHALIMIDE”. Organic Syntheses. 2: 75. 1922. DOI:10.15227/orgsyn.002.0075. eISSN 2333-3553. ISSN 0078-6209. Дата обращения 2020-09-11.
- “SUCCINIMIDE”. Organic Syntheses. 16: 75. 1936. DOI:10.15227/orgsyn.016.0075. ISSN 2333-3553. Дата обращения 2020-09-11.
- “β-BROMOETHYLPHTHALIMIDE”. Organic Syntheses. 32: 18. 1952. DOI:10.15227/orgsyn.032.0018. eISSN 2333-3553. ISSN 0078-6209. Дата обращения 2020-09-11.
- Bozdoğan, Burcu; Erşatır, Mehmet; Demirkol, Onur; Akbaşlar, Dilek; Giray, E. Sultan (2017-02-01). “Simple and efficient synthesis of N-alkyl and N-aryl succinimides in hot water”. Synthetic Communications. 47 (3): 217—223. DOI:10.1080/00397911.2016.1258479. ISSN 0039-7911. Дата обращения 2020-09-12. (Full text at ResearchGate)
- Chiriac, Constantin I; Nechifor, Marioara; Tanasă, Fulga (2007). “FORMAMIDE, A NOVEL CHALLENGING REAGENT FOR THE DIRECT SYNTHESIS OF NON-N-SUBSTITUTED CYCLIC IMIDES”. Revue Roumaine de Chimie. 52 (8—9): 883—886. ISSN 0035-3930.
- Liu, Luxiao; Zhang, Hong-Yu; Yin, Guohui; Zhang, Yuecheng; Zhao, Jiquan (2020-04-01). “Synthesis of N-unsubstituted cyclic imides from anhydride with urea in deep eutectic solvent (DES) choline chloride/urea”. Chemical Papers. 74 (4): 1351—1357. DOI:10.1007/s11696-019-00969-6. ISSN 1336-9075. Дата обращения 2020-09-13.
- Rothman, Edward S.; Serota, Samuel; Swern, Daniel (1964-03-01). “Enol Esters. II.1a N-Acylation of Amides and Imides”. The Journal of Organic Chemistry. 29 (3): 646—650. DOI:10.1021/jo01026a031. ISSN 0022-3263. Дата обращения 2020-09-12.
- Yamamoto, Yutaka (1981). “A New Method for Preparation of N-Acetoacetyl-carboxamides”. Synthesis. 1981(2): 122—124. DOI:10.1055/s-1981-29355. Дата обращения 2020-09-13.
- Аненко, Д.; Кодониди, И.; Глушко, А.; Чиряпкин, А.; Смирнова, Л. “N-ацилирование амида фенилуксусной кислоты - синтез и изучение термодинамических характеристик реакции”. Бюллетень науки и практики. 6 (1): 10—13. DOI:10.33619/2414-2948/50/01. ISSN 2414-2948. Дата обращения 2020-09-12.
- Yamada, Shinji; Yaguchi, Setsuko; Matsuda, Kaori (2002-01-21). “N-Acylation of amides with acid anhydrides by way of dual activation using MgBr2·OEt2”. Tetrahedron Letters. 43 (4): 647—651. DOI:10.1016/S0040-4039(01)02208-0. ISSN 0040-4039. Дата обращения 2020-09-12.
- Schwarz, J. S. Paul. (1972-09). “Preparation of acyclic isoimides and their rearrangement rates to imides”. The Journal of Organic Chemistry. 37 (18): 2906—2908. DOI:10.1021/jo00983a028. eISSN 1520-6904. ISSN 0022-3263. Дата обращения 2020-09-18. Проверьте дату в
|date=(справка на английском) - Chen, Jijun; Shao, Ying; Ma, Liang; Ma, Meihua; Wan, Xiaobing (2016-11-16). “In situ generation of nitrilium from nitrile ylide and the subsequent Mumm rearrangement: copper-catalyzed synthesis of unsymmetrical diacylglycine esters”. Organic & Biomolecular Chemistry. 14 (45): 10723—10732. DOI:10.1039/C6OB02037B. ISSN 1477-0539. Дата обращения 2020-09-18.
- Mei, Chong; Hu, Yixin; Lu, Wenjun (2018-08). “Visible-Light-Driven Oxidation of N-Alkylamides to Imides Using Oxone/H2O and Catalytic KBr”. Synthesis. 50 (15): 2999—3005. DOI:10.1055/s-0036-1591575. eISSN 1437-210X. ISSN 0039-7881. Дата обращения 2020-09-18. Проверьте дату в
|date=(справка на английском)
Литература
- Имиды // Малый энциклопедический словарь Брокгауза и Ефрона : в 4 т. — СПб., 1907—1909.
- Имиды кислот — статья из Большой советской энциклопедии.