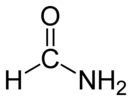
Формамид
Формамид — амид муравьиной кислоты, простейший карбоксамид — первый член гомологического ряда амидов карбоновых кислот.
| Формамид | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | формамид | ||
| Хим. формула | CH3NO | ||
| Рац. формула | HCONH2 | ||
| Физические свойства | |||
| Состояние | прозрачная, вязкая жидкость | ||
| Молярная масса | 45,04 г/моль | ||
| Плотность | 1,13 г/см³ | ||
| Энергия ионизации | 10,2 ± 0,1 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 2-3 °C | ||
| • кипения | 210 °C | ||
| • разложения | 411 ± 1 ℉[1] | ||
| • вспышки | 154 °C | ||
| Давление пара | 0,1 ± 0,1 мм рт.ст.[1] | ||
| Классификация | |||
| Рег. номер CAS | 75-12-7 | ||
| PubChem | 713 | ||
| Рег. номер EINECS | 200-842-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | LQ0525000 | ||
| ChEBI | 16397 | ||
| ChemSpider | 693 | ||
| Безопасность | |||
| Предельная концентрация | 0,035 мг/м³ | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Свойства
Формамид представляет собой бесцветную жидкость без запаха, гигроскопичен, смешивается с водой, низшими спиртами, хлороформом, ацетоном, нерастворим в углеводородах.
Под действием дегидратирующих агентов (P2O5 и т. п.) формамид дегидратируется с образованием синильной кислоты, эта реакция аналогично образованию нитрилов при дегидратации амидов карбоновых кислот:
Дегидратация формамида с образованием синильной кислоты также протекает при температурах ~500 °C и выше при катализе оксидом алюминия и алюмосиликатами.
При атмосферном давлении и температурах выше 160 °C формамид разлагается с образованием аммиака и оксида углерода:
При температуре кипения скорость разложения составляет ~0,5 % в минуту, при этом незначительная часть формамида разлагается с образованием аммиака и синильной кислоты.
При комнатной температуре формамид устойчив к гидролизу, гидролизуется под действием щелочей и сильных кислот, под действием спиртов происходит алкоголиз с образованием формиатов.
Синтез и применение
В промышленности формамид синтезируют из аммиака и оксида углерода, при этом используются два варианта процесса синтеза — одностадийный прямой и двухстадийный через промежуточный синтез метилформиата.
При прямом синтезе формамид образуется при взаимодействии аммиака с окисью углерода в метанольном растворе метилата натрия CH3ONa при температуре 80-100 °C и давлении 10-30 МПа, по завершении реакции из реакционной смеси отгоняют метанол, извлекают на регенерацию метилат натрия и соли, после чего ректифицируют сырой формамид.
В двухстадийном процессе сначала карбонилированием метанола в присутствии метилата натрия синтезируют метилформиат:
Сырой метилформиат очищают, после чего проводят его аммонолиз при температуре 80-100 °C и давлении 2-6 МПа:
Образовавшийся при аммонолизе метанол после очистки возвращают на первую стадию.
Формамид используется в качестве сырья в производстве синильной кислоты (дегидратация формамида) и муравьиной кислоты (гидролизом формамида), также используется при синтезе пурина из мочевой кислоты[2].
Токсичность
Токсичен. Проникает через неповреждённую кожу, имеет общетоксическое и эмбриотоксическое действие, вызывает поражение печени, нервной системы и сердечно-сосудистых тканей, способен накапливаться в организме[3].
Примечания
- http://www.cdc.gov/niosh/npg/npgd0295.html
- Синтез - пурин. Большая энциклопедия нефти и газа. Дата обращения: 6 мая 2013.
- Вайсбергер и др., 1958.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с.
- Органические растворители : Физические свойства и методы очистки / А. Вайсбергер, Э. Проскауэр, Дж. Риддик, Э. Тупс ; Пер. с англ. Н. Н. Тихомировой ; под ред. Я. М. Варшавского. — M. : Изд. иностр. лит-ры, 1958. — С. 434–436.