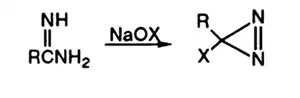Гипохлориты
Гипохлори́ты — соли и эфиры хлорноватистой кислоты .
Гипохлориты в свободном безводном состоянии являются неустойчивыми соединениями, многие при нагреве разлагаются со взрывом. Гипохлориты щелочных и щелочноземельных металлов хорошо растворимы в воде и образуют кристаллогидраты, разлагающиеся при хранении.
Химические свойства
Гипохлориты в водных растворах разлагаются, при этом преобладающее направление реакции разложения зависит от pH и температуры.
В сильнокислых растворах (pH ≤ 3), в которых гипохлориты практически полностью гидролизованы и при комнатной температуре преобладает разложение хлорноватистой кислоты до хлора и кислорода:
- .
В слабокислых и нейтральных растворах (pH 3—7,5) идёт реакция:
- .
В нейтральной среде гипохлориты диспропорционируют до хлоридов и хлоратов, реакция медленно протекает уже при комнатной температуре и ускоряется при нагревании, при температурах выше 70 °C эта реакция становится преобладающей; такое диспропорционирование является промышленным методом получения хлоратов:
- .
Гипохлориты являются сильными окислителями, при этом окисляющая способность в растворе сильно зависит от pH среды. Так, иодид-ион при pH ≤ 4 окисляется до свободного йода , при pH 5—7 — до иодата , при pH ≥ 4 — до периодата . Ионы переходных металлов в низших степенях окисления зачастую окисляются до высших степеней (например, соли хрома окисляются до хроматов, марганца — до перманганатов).
Гипохлориты в щёлочном растворе реагируют с пероксидом водорода с образованием хлорида и кислорода, особенностью этой реакции является то, что кислород высвобождается не в основном, триплетном, состоянии, а в возбуждённом синглетном, что обусловливает его высокую активность и фосфоресценцию в ближнем ИК-диапазоне (~ 1270 нм):
- .
Гипохлориты взаимодействуют с аминами, образуя N-хлорамины:
- .
Аналогично идет и реакция с аммиаком; взаимодействие избытка аммиака с гипохлоритом натрия под давлением (2,5—3,0 МПа, 160°С) используют в промышленном производстве гидразина (процесс Рашига)[1], этот же метод при атмосферном давлении применяется и для лабораторного синтеза[2]:
- ,
- .
Применение в органическом синтезе
- Термическая или фотохимическая изомеризация алкилгипохлоритов является методом синтеза к δ-хлорспиртов (δ-хлоргидринов)
- Реакция Гофмана: взаимодействие амидов карбоновых кислот с гипохлоритами ведёт к внутримолекулярной группировке в соответствующие изоцианаты которые в дальнейшем, в зависимости от условий проведения реакции, могут гидролизоваться до первичных аминов или, в присутствии спиртов, образовывать уретаны:
- .
- Реакция гипохлоритов с мочевиной является одним из промышленных методов синтеза гидразина:
- .
- Реакция оснований Шиффа с алкилгипохлоритами ведёт к образованию неустойчивых N-хлорпроизводных, перегруппировывающихся в α-аминокетоны
- Взаимодействие амидинов с гипогалогенитами используется как метод синтеза диазиринов[3], использующихся в органическом синтезе в качестве предшественников карбенов[4]:
- Окисление ароматических о-нитроаминов до конденсированных фуроксанов.
Применение в промышленности
Исторически первым гипохлоритом, нашедшим промышленное применение, был гипохлорит калия, который в составе т. н. «жавелевой воды» (фр. Eau de Javelle — раствор гипохлорита и хлорида калия, получавшийся пропусканием хлора через раствор поташа), применялся для отбелки целлюлозных тканей с конца XVIII века.
Гипохлориты натрия и кальция являются крупнотоннажными продуктами, их получают, пропуская хлор через раствор или суспензию соответствующего гидроксида с дальнейшей кристаллизацией кристаллогидрата гипохлорита. Значительная часть произведённых таким методом гипохлоритов применяется без выделения, то есть в смеси с соответствующим хлоридом, например, смесь гипохлорита и хлорида кальция — хлорная известь.
Благодаря низкой стоимости и тому, что гипохлориты являются сильными окислителями, их применяют как отбеливающее средство в текстильной, бумажной, целлюлозной промышленности, для дезинфекции питьевых и сточных вод и др., а также как дегазаторы серосодержащих и фосфорорганических отравляющих веществ.
Биологическое значение
Гипохлорит-анион образуется при окислении хлорид-аниона, катализируемого миелопероксидазой нейтрофильных гранулоцитов и в качестве одного из биоцидных факторов (т. н. активных форм кислорода) участвует в защите организма от бактериальных и грибковых инфекций. Так, в частности, кроме прямого цитотоксического действия, взаимодействие гипохлорита с перекисью водорода приводит к выделению кислорода в высокотоксичном синглетном состоянии:
- .
Примечания
- Schirmann, Jean-Pierre & Bourdauducq, Paul (2001), Hydrazine, Ullmann's Encyclopedia of Industrial Chemistry, DOI 10.1002/14356007.a13_177
- Adams, R. & Brown, B. K. (1941), Hydrazine Sulfate, Org. Synth., <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0309>; Coll. Vol. Т. 1: 309
- Graham, W. H. The Halogenation of Amidines. I. Synthesis of 3-Halo- and Other Negatively Substituted Diazirines1 (англ.) // Journal of the American Chemical Society : journal. — 1965. — 1 October (vol. 87, no. 19). — P. 4396—4397. — ISSN 0002-7863. — doi:10.1021/ja00947a040.
- Albert Padwa; Mitchell J. Pulwer & Thomas J. Blacklock (1981), Preparation of chlorophenyldiazirine and thermal generation of chlorophenyl carbene: 1,2-diphenyl-3-methylcyclopropene, Org. Synth., <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV7P0203>; Coll. Vol. Т. 60: 53
Литература
- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с. — 100 000 экз.