Антихолинергический синдром
Антихолинергический синдром (АХС) — сравнительно редкое, однако потенциально опасное для жизни критическое состояние, в основе которого лежит абсолютное или относительное снижение холинергической активности. Обусловлено приёмом веществ, обладающих антихолинергическими (холинолитическими) свойствами[1].
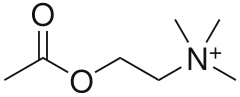
Антихолинергический синдром впервые был описан V. G. Longo в 1966 году. В российских авторитетных источниках информации по этой теме почти нет; в зарубежных источниках чаще всего приводятся описания отдельных случаев или небольших серий, а описания обзорного характера немногочисленны[1].
Эпидемиология
Частота антихолинергического синдрома, по данным различных авторов, колеблется от 1 до 11,2%. Согласно отчётам Американской ассоциации центров контроля отравлений, в 2007 году он был выявлен у 8582 лиц; в 2008 году было выявлено около 20 000 случаев АХС. Однако смертельных исходов ни в 2007, ни в 2008 году не было отмечено, в то время как в предшествующий период (1997—2004 годы) был зарегистрирован 51 случай летальных исходов при антихолинергическом синдроме.
АХС встречается с примерно одинаковой частотой у лиц обоего пола. Особенно часто он встречается у взрослых, но описан также у детей; часто АХС развивается у лиц пожилого и старческого возраста.
Патогенез
Механизм действия антихолинергических средств (иначе называемых М-холинолитическими средствами) заключается в том, что они устраняют эффекты одного из важнейших нейротрансмиттеров в организме — ацетилхолина, блокируя М-холинореактивные системы (рецепторы) нейронов центрального и вегетативного отделов нервной системы.
Действие ацетилхолина на периферические М-холинорецепторы сопровождается расширением кровеносных сосудов, замедлением сердечной деятельности, понижением артериального давления, усилением перистальтики, сужением зрачков, усилением сокращения гладкой мускулатуры бронхов (бронхоспазм), матки, жёлчного и мочевого пузырей, повышением секреции бронхиальных, слюнных и потовых желёз. Действие антихолинергических средств на периферии приводит к противоположным эффектам.
В ЦНС ацетилхолин оказывает влияние на регуляцию сна и бодрствования, внимание, обучение и память, чувство жажды, болевую чувствительность, терморегуляцию, на некоторые аспекты локомоторной активности (включая модуляцию эффектов дофамина). Степень выраженности проявлений антихолинергического синдрома со стороны ЦНС связана со способностью препаратов, обладающих антихолинергическим действием, проникать через гемато-энцефалический барьер. Кроме того, имеет значение, что синапсы, содержащие М-рецепторы, располагаются как на тормозных, так и на возбуждающих нейронах коры и базальных ганглиев. По этой причине последствия блокады или активации М-рецепторов на поведенческом уровне очень индивидуальны: их выраженность и направленность зависят от химической структуры того или иного препарата.
Стоит также отметить, что угнетение М-холинергической трансмиссии (блокада М-рецепторов) обусловлено не только антихолинергическим действием препаратов, но зависит и от патологических эффектов со стороны других нейротрансмиттерных систем.
Этиология
Антихолинергический синдром развивается при передозировке холинолитических средств либо (сравнительно редко) является патологической реакцией организма на их терапевтические дозы вследствие лекарственной непереносимости. Развитие АХС у пожилых лиц часто обусловлено взаимодействием различных препаратов.
Известно около 600 веществ, обладающих антихолинергическим действием, в том числе официальные прописываемые медикаменты, свободно продающиеся лекарства, запрещённые рекреационные препараты, а также многие растения. Поэтому АХС является большой проблемой в клинической практике.
К препаратам, обладающим М-холинолитическим действием, относятся следующие классы лекарств:
- холинолитики (атропин, скополамин, тропикамид, гоматропин, бензтропин, тригексифенидил, проциклидин, орфенадрин)
- антигистаминные препараты (димедрол, пипольфен, супрастин, тавегил, тримепразин)
- трициклические антидепрессанты (амитриптилин, кломипрамин, имипрамин, дезипрамин, доксепин, нортриптилин, протриптилин, амоксапин)
- бензодиазепины
 Капсулы нортриптилина, антидепрессанта с холинолитическим действием
Капсулы нортриптилина, антидепрессанта с холинолитическим действием - антипаркинсонические средства
- снотворные (доксиламин)
- жаропонижающие средства
- анальгетики
- кортикостероиды
- антигипертензивные средства
- галлюциногены
- антипсихотики (аминазин, пропазин, тиоридазин, дроперидол, клозапин, оланзапин, кветиапин и др.)
- спазмолитики (клидиниум, дицикломин, гиоксамин, оксибутинин, пропантелин)
- мидриатики (циклопентолат, гоматропин, тропикамид)
- опиоиды
- антималярийные препараты (мефлохин)
- внутривенные анестетики (кетамин, пропофол)
- закись азота и ингаляционные анестетики (галотан, энфлуран)
Кроме того, описаны случаи развития АХС после применения ципрогептадина, карбамазепина, циклобензаприна, налоксона, дименгидрината, циметидина, этомидата.
Антихолинергический синдром часто возникает вследствие приёма широкого разнообразия прописываемых лекарств и лекарств, принимаемых самостоятельно. Нередко он развивается при совместном приёме нескольких психотропных средств — например, сочетании антипсихотиков, трициклических антидепрессантов и/или антипаркинсонических препаратов.

Системный эффект, приводящий к развитию АХС, может оказаться результатом в том числе местного применения лекарств, содержащих антихолинергические средства, например глазных капель, накожных аппликаций (скополаминовый пластырь), назальных спреев. Глазные капли всасываются местно конъюнктивой, слизистой оболочкой носослёзного протока, носовой полости и носоглотки, куда может попадать избыток лекарственного средства из конъюнктивального мешка. При этом вещество с холинолитическими свойствами, содержащееся в каплях, попадает в кровь, минуя печёночный барьер. Кроме того, активные вещества, содержащиеся в каплях, могут проникать непосредственно в головной мозг через систему окологлазных вен и кавернозный синус.
Преднамеренное употребление галлюциногенных растений и грибов тоже может вызвать антихолинергический синдром из-за присутствия в них алкалоидов, оказывающих антихолинергическое действие. В источниках описаны многочисленные случаи отравлений холинолитическими средствами растительного происхождения. Большинство растений, обладающих антихолинергическим действием, принадлежат к семейству паслёновых, многие виды которого богаты алкалоидами, токсичными для человека. Группа растительных алкалоидов с холинолитическим действием (тропановые алкалоиды) включает в себя атропин, гиосциамин и гиосцин и содержится приблизительно в 2000 видов растений.
Основные виды растений, в которых содержатся тропановые алкалоиды:
- Atropa belladonna (красавка)
- Mandragora officinarum (мандрагора)
- Datura species (дурман)
- Brugmansia (трубы ангелов)
- Hyoscyamus niger (белена)
- Lupinus species (люпин)
Случаи тяжёлого АХС возможны и при приёме китайского травяного чая.
Факторы риска
На риск развития антихолинергического синдрома влияет состояние организма пациента и уровень его функциональной предрасположенности к воздействию холинолитических средств. В частности, у лиц, длительное время принимающих препараты с холинолитическими свойствами, например трициклические антидепрессанты, может выработаться толерантность к ним, и признаки АХС в этих случаях не проявляются даже при высоком уровне препаратов в крови. Напротив, у пациентов, имеющих сниженные холинергические резервы, АХС может развиться при дозах препаратов ниже обычных токсических. Кроме того, влияние могут оказывать заболевания, изменяющие обмен ацетилхолина в организме, или добавление в схему лечения новых препаратов с холинолитическими свойствами.
Наиболее высокий риск развития антихолинергического синдрома характерен для пожилых пациентов и детей. Возрастное снижение холинергических резервов организма, характерное для лиц пожилого возраста, увеличивает восприимчивость пациентов к побочным эффектам холинолитических средств. Кроме того, в силу некоторых особенностей фармакокинетики и фармакодинамики лекарственных препаратов у пожилых пациентов они более подвержены повышению уровня лекарств в организме. Лицам пожилого возраста гораздо чаще, чем молодым, назначаются препараты с холинолитическими свойствами (например, для лечения эмфиземы лёгких, недержания мочи и др.). Указанные факторы приводят к тому, что пациенты пожилого возраста испытывают в 2—3 раза больше антихолинергических реакций, чем население в целом, и это оказывает большое влияние на уровень смертности в данной возрастной группе.
В авторитетных источниках подчёркивается значимость такого фактора развития АХС у пожилых пациентов и детей, как глазные капли, содержащие холинолитические средства (например, атропин или тропикамид — атропин короткого действия). В частности, пожилые пациенты могут испытывать трудности при самостоятельном закапывании лекарства вследствие часто наблюдающегося у них тремора, и это приводит к передозировке глазных капель.
Нередки также случаи антихолинергического синдрома после анестезии: их частота в некоторых источниках оценивается как 9,4—10% после общего наркоза и 3,3—4% после местного обезболивания с седацией; в других источниках есть заявления даже о 40% случаев; в третьих указывается, что частота АХС в послеоперационном периоде составляет 1—9%. Наиболее опасными в смысле послеоперационного развития АХС препаратами для премедикации являются, по мнению некоторых авторов, дроперидол, диазепам и фенобарбитал.
Описаны случаи возникновения антихолинергического синдрома после коронарной ангиографии и при эхокардиографии с добутамин-атропиновой нагрузкой.
Антихолинергический синдром с проявлениями гиперактивности может развиться у пациентов, находящихся на аппаратном дыхании, особенно при длительном употреблении высоких доз седативных препаратов. Дальнейшее применение искусственной вентиляции лёгких у таких пациентов крайне затруднено и требует дополнительной мышечной релаксации. В таких случаях при отключении искусственной вентиляции лёгких может быть полезен физостигмин.
По некоторым утверждениям, к факторам риска возникновения АХС относятся длительная терапия бензодиазепинами, а также печёночная энцефалопатия.
Клиника
Клиническая картина антихолинергического синдрома складывается из патологических эффектов со стороны как ЦНС, так и периферической парасимпатической нервной системы, но чаще всего имеют место оба вида нарушений. Симптомы со стороны ЦНС варьируют в широких пределах — от седации и лёгких когнитивных нарушений до комы. Центральный антихолинергический синдром может проявляться в двух формах: гиперактивной либо депрессивной.
Гиперактивная форма, часто ассоциирующаяся с действием атропина, может включать в себя беспокойство, страх, возбуждение, зрительные и слуховые галлюцинации, нарушения кратковременной памяти, ажитированный делирий, гипертермию центрального генеза, атаксию, конвульсии, миоклонус, судорожные припадки. У детей АХС чаще всего проявляется возбуждением, гиперактивностью, беспокойством, внезапно возникающими пароксизмами агрессивности.
Депрессивная форма, которая часто ассоциируется с действием скополамина и наблюдается, как правило, после общей анестезии, проявляется сомноленцией, ступором, комой, угнетением дыхания. У пожилых пациентов нередко встречается симптом кофрологии — хватание воображаемых предметов или перебирание постельного белья.
У пациентов с тяжёлым центральным антихолинергическим синдромом может развиваться кома, которая наблюдается менее чем у 1/3 больных с диагностированным АХС, причём в два раза чаще у взрослых, чем у детей, и, как правило, поздно в ходе развития заболевания.
К симптомам со стороны периферической нервной системы относятся сухая, горячая и красная (из-за прилива крови) кожа; снижение секреции желёз; сухость слизистых оболочек; мидриаз с отсутствием реакции зрачков; нарушение аккомодации; светобоязнь; тахикардия; артериальная гипертензия; расширение пульсового давления; замедленная желудочная эвакуация и перистальтика кишечника (уменьшение кишечных шумов) вплоть до динамического илеуса; запор; задержка мочи (в особенности у мужчин с аденомой предстательной железы); повышение мышечного тонуса, за которым следуют глубокая слабость мышц и миотонические подёргивания.
Более чем в 25% случаев антихолинергического синдрома наблюдается гипертермия. Основная её причина — центральное действие веществ с антихолинергическим эффектом, нарушающее процессы терморегуляции, и отсутствие потоотделения.
У поздно госпитализированных пациентов с АХС бывает более выражена центральная симптоматика из-за повышения с течением времени концентрации холинолитических веществ в ЦНС или по причине толерантности к периферическим холинолитическим эффектам.
Лабораторные данные
Специфических лабораторных тестов для диагностики антихолинергического синдрома не существует. Определение концентрации лекарств в крови мало помогает и используется лишь в редких случаях. Тем не менее иногда биохимия плазмы крови и электролитный состав могут стать ключевыми для определения токсических агентов и принимаемых совместно препаратов. Поэтому при всех преднамеренных отравлениях следует проводить соответствующие токсикологические исследования, так как часто имеет место использование сочетаний препаратов и многократный их приём.
У пациентов с высокой температурой необходимо исследовать кровь и мочу на стерильность, а при наличии к тому же нарушений психики проводить исследование ликвора. Женщинам детородного возраста нужно проводить тестирование мочи на беременность.
Пациентам с психическими нарушениями при невыясненном лекарственном анамнезе или при резистентности к проводимому лечению показаны методы прижизненной визуализации головного мозга (КТ и МРТ). При поступлении пациента в специализированный стационар сразу же должна быть снята электрокардиограмма. При сильной передозировке лекарств с холинолитическими свойствами на ЭКГ наблюдается расширение комплекса QRS (свыше 100 миллисекунд); могут отмечаться также атриовентрикулярная блокада, желудочковая и предсердная тахикардия.
Клиническое течение
Оно крайне вариабельно по тяжести (от лёгких когнитивных расстройств до тяжёлой комы) и спектру (возбуждение или депрессия). Как правило, антихолинергический синдром развивается быстро — через 1—4 часа после приёма препаратов с антихолинергическим действием — и неожиданно. Прогноз расстройства чаще всего благоприятный, серьёзные поздние осложнения не описаны. В отдельных случаях симптомы расстройства, опасные для жизни, сохраняются в течение 15 часов после появления первых симптомов. Более того, делирий и некоторые другие признаки, в частности мидриаз, иногда сохраняются несколько дней, а когнитивные расстройства могут сохраняться до 15—30 суток.
Тем не менее некоторые препараты с холинолитическими свойствами могут вызвать смертельный исход — например, орфенадрин, смерть при отравлении которым наступает через несколько часов от судорожных припадков, острой сердечной недостаточности или аритмий. В некоторых случаях возможно повторное развитие (рецидивирующее течение) антихолинергического синдрома.
Диагностика
Имеет место частая гиподиагностика АХС, особенно при взаимодействии двух веществ с холинолитическим действием, например при совместном приёме фенотиазинов и антидепрессантов. Гиподиагностика обусловлена как значительным разнообразием проявлений синдрома, так и недостаточной осведомлённостью врачей в вопросах данной патологии.
Диагноз антихолинергического синдрома должен быть основан на выявлении клинических симптомов расстройства, исключении другой возможной патологии и позитивном ответе на пробное введение ингибитора холинэстеразы физостигмина. Очень важно собрать точный и достоверный лекарственный и пищевой анамнез, который должен включать сведения о принимавшихся медикаментах, продуктах растительного происхождения, пищевых добавках. В случае выраженных когнитивных нарушений у пациента, препятствующих выяснению анамнеза, следует пытаться получить достоверную информацию от других осведомлённых лиц.
Для диагностики антихолинергического синдрома необходимо наличие и центральных, и периферических его проявлений. Принято выставлять диагноз этого расстройства при наличии одного центрального и минимум двух периферических симптомов. По другому мнению (R. C. W. Hall с соавторами, 1978), диагноз АХС можно ставить только на основании центральных симптомов. A. Frampton и J. Spinks (2005) считают важным признаком антихолинергического синдрома отсутствие потоотделения при выраженной лихорадке.
Чёткие критерии диагностики антихолинергического синдрома отсутствуют, АХС считается «диагнозом исключения». При подозрении на АХС у пациентов с делирием и/или неясным анамнезом может использоваться тест с физостигмином (быстрое улучшение состояния через 30 минут после внутримышечного введения подтверждает диагноз). При мидриазе может быть полезно применение пилокарпина, помогающее определить, обусловлено ли расширение зрачков антихолинергическим эффектом или имеет другую причину.
У пожилых психически больных, нередко получающих комбинацию антипсихотиков и трициклических антидепрессантов, при возникновении и нарастании стойкого возбуждения может быть нелегко отличить ажитацию, возникшую как проявление основного заболевания, от АХС. Гиподиагностика АХС в таких случаях может ухудшить состояние больного вследствие повышения доз препаратов, назначенных против предполагаемой ажитации.
Дифференциальная диагностика
Для АХС характерны достаточно отчётливые признаки, позволяющие успешно проводить дифференциальную диагностику. К таким признакам относятся уровень сознания; размер зрачков и их реакция; миоклонические подёргивания, судорожные припадки, гиперрефлексия; нистагм; частота сердечных сокращений; кишечные шумы; изменения ЭКГ; ответ на введение холиномиметиков; содержание в крови препаратов, могущих быть причиной антихолинергического синдрома. Важный момент дифференциальной диагностики — достоверный лекарственный анамнез.
Дифференциальную диагностику АХС следует проводить с такими заболеваниями и патологическими состояниями:
- злокачественный нейролептический синдром;
- серотониновый синдром;
- злокачественная гипертермия;
- гипогликемия (в частности, при отравлении растениями, понижающими уровень сахара в крови);
- менингит и энцефалит;
- детская лихорадка и детская тахикардия;
- интоксикации (в том числе ингибиторами МАО, галлюциногенами, фенциклидином, симпатомиметиками, тиреоидными гормонами, ядовитыми грибами).
Злокачественный нейролептический синдром (ЗНС) имеет ряд проявлений, наблюдающихся и при антихолинергическом синдроме, что обусловливает трудности при разграничении этих расстройств. При обоих этих синдромах наблюдаются гипертермия, нарушения сознания, тахикардия, но при АХС эти симптомы обычно не так тяжелы, как при ЗНС. Кроме того, при антихолинергическом синдроме обычно не бывает таких проявлений ЗНС, как потливость, бледность, слюнотечение, брадирефлексия, выраженная мышечная ригидность, повышение креатинфосфокиназы. С другой стороны, такие постоянные признаки АХС, как мидриаз и снижение секреции желёз, сухость и покраснение кожи, сухость слизистой рта, обычно не встречаются при ЗНС. В отличие от АХС, злокачественный нейролептический синдром может развиваться более медленно: в течение нескольких суток после приёма вызвавших его препаратов.
Серотониновому синдрому присущи такие признаки, как нейромышечные нарушения, потливость, слюнотечение, гиперактивация кишечных шумов, нормальный цвет кожи, отличающие это расстройство от АХС; для пациентов с АХС характерны нормальные рефлексы, и у них наблюдается так называемый «токсидром» в виде мидриаза, ажитированного делирия, сухой слизистой полости рта, сухости, жара и покраснения кожи, задержки мочи, отсутствия кишечных шумов.
Злокачественную гипертермию от АХС можно отличить благодаря таким признакам, как наблюдающиеся при ней мышечная ригидность, гипорефлексия, потливость, часто — пёстрая окраска кожных покровов. В отличие от АХС, при злокачественной гипертермии не наблюдаются сухость, жар и покраснение кожи, не наблюдается также мидриаз.
При отравлении симпатомиметиками (кофеин, метамфетамин) отмечаются некоторые симптомы, сходные с антихолинергическим синдромом: сухость во рту, тахикардия, уменьшение кишечных шумов, ажитация, однако температурная реакция выражена более значительно и, как правило, сопровождается потоотделением, а со стороны психической сферы преобладает возбуждение со склонностью к агрессивности.
Антихолинергический синдром, развившийся после анестезии, необходимо дифференцировать с передозировкой анестетиков или изменением их фармакокинетики, нарушением водно-электролитного и/или кислотно-щелочного баланса, гипогликемией, гипоксией, гиперкапнией, уремией, гипер- или гипотермией, дисгормональными нарушениями, неврологической патологией, возникшей вследствие операции, эмболии, кровотечения или травмы.
Лечение
Для успешности лечения очень важна быстрая диагностика АХС. Пациентов с антихолинергическим синдромом нужно немедленно госпитализировать в ближайшее лечебное учреждение, где есть условия для проведения интенсивной терапии. Первый и наиболее важный терапевтический шаг — отмена препарата, вызвавшего заболевание. Необходимо осмотреть кожу пациента на предмет возможного чрескожного попадания вещества с антихолинергическим эффектом (например, скополамина при аппликации скополаминового пластыря) и при обнаружении обработать соответствующие участки[1].
В период до госпитализации основное внимание нужно уделять состоянию сердечно-сосудистой, дыхательной и нервной систем. При психических нарушениях назначить налоксон и тиамин и устранить возможную гипергликемию. Для снятия возбуждения и предотвращения судорожных припадков рекомендуется использовать бензодиазепины. Применения рвотных средств и активированного угля необходимо избегать, если не предвидится длительная транспортировка пациента. Использовать физостигмин в этот период тоже не рекомендуется. При отравлении холинолитическими средствами снижает риск развития АХС рибоксин, вводимый внутривенно[1].
В стационаре необходимо проводить симптоматическое поддерживающее лечение. Сразу же при поступлении в отделение реанимации или в палату интенсивной терапии следует провести ревизию дыхательных путей и в дальнейшем осуществлять постоянный контроль респираторной функции. При выраженной депрессии ЦНС или угнетении дыхания показана интубация с искусственной вентиляцией лёгких и оксигенотерапия[1].
Рекомендуется установить венозный катетер и проводить мониторинг ЭКГ, ЧСС, АД и напряжения кислорода в крови. Снятие электрокардиограммы необходимо сразу же при поступлении. Часто наблюдающаяся синусовая тахикардия не требует непременной терапии у стабильных больных. При расширении комплекса QRS (свыше 100 миллисекунд) или в случае высокой (более 3 мм) волны R в AVR-отведении следует применять бикарбонат натрия. При желудочковых аритмиях следует применять лидокаин, бикарбонат натрия, магнезию, а также гипервентиляцию. Артериальная гипертензия лечения обычно тоже не требует, но при необходимости назначают общую терапию (нитропруссид натрия, антагонисты кальция)[1].
Необходимо как можно скорее провести исследование крови (в первую очередь определить уровень сахара) и тщательно обследовать пациента для исключения травмы[1].
При ажитации могут применяться физическая фиксация пациента или лекарственное сдерживание (бензодиазепины: диазепам, клоназепам или мидазолам; лечение ими рассматривается как метод выбора в случаях явного делирия при подозрении на приём холинолитических средств). Впрочем, некоторые авторы считают применение бензодиазепинов спорным и рекомендуют физостигмин как безопасное и более эффективное средство для купирования ажитированного делирия, если на ЭКГ нет признаков нарушений проводимости (удлинение интервалов PR и QRS)[1].
Нейролептики фенотиазинового ряда противопоказаны при АХС по причине их холинолитических свойств. При наличии галлюцинаций не требуется их специальное лечение, если нет заметного психомоторного возбуждения. В случае задержки мочи проводится катетеризация мочевого пузыря[1].
Судорожные припадки рекомендуется купировать бензодиазепинами, преимущественно диазепамом или лоразепамом; в резистентных случаях — барбитуратами[1].
Вслед за начальной стабилизацией у больных с отравлениями холинолитическими средствами при приёме их внутрь необходимо очистить желудочно-кишечный тракт. Для этого применяется активированный уголь (со слабительным или без него) через рот или назогастральный зонд. У большинства пациентов одного только приёма активированного угля достаточно для очищения желудка и кишечника. Активированный уголь показан даже через несколько часов после отравления, поскольку вещества с антихолинергическим эффектом снижают перистальтику и задерживают эвакуацию кишечного содержимого. Напротив, промывание желудка эффективно только в течение часа после отравления, поскольку большинство лекарств или токсинов всасывается на протяжении 30—90 минут. По этой же причине неэффективны и слабительные средства; более того, их применение у маленьких детей может привести к опасным сдвигам водно-электролитного баланса[1].
Меры по очищению ЖКТ часто приводят к улучшению состояния пациента при условии адекватной поддерживающей терапии. Тахикардия нередко проходит после инфузии кристаллоидов, снятия возбуждения (с помощью бензодиазепинов или других мер) и снижения температуры путём переливания жидкостей, путём применения жаропонижающих и активных мер внешнего охлаждения[1].
Так как большинство веществ с антихолинергическим эффектом высокорастворимы в жирах, имеют широкий объём распространения в организме и очень сильно связаны с белками, то гемодиализ и гемотрансфузия неэффективны. Иногда бывает полезен форсированный диурез[1].
Антидотом при антихолинергическом синдроме является салицилат физостигмина — обратимый ингибитор ацетилхолинэстеразы, фермента, отвечающего за расщепление ацетилхолина. Физостигмин способен эффективно купировать как центральные, так и периферические проявления антихолинергического синдрома. Высокая эффективность физостигмина при АХС отмечается во многих публикациях[1].
В большинстве случаев пациентов с АХС можно успешно лечить без физостигмина, но его применение рекомендуется, если имеется хотя бы одно из следующих проявлений АХС: тахиаритмия с последующими гемодинамическими нарушениями; стойкие судорожные припадки; сильное возбуждение или психоз с потенциальной опасностью для себя или окружающих[1].
Для физостигмина характерен ряд нежелательных побочных действий, ограничивающих сферу его применения: кардиотоксичность; периферические холинергические проявления (рвота, диарея, абдоминальные спазмы, потливость, бронхоспазм); судорожные припадки (как правило, у пациентов с отравлениями трициклическими антидепрессантами); у этих же пациентов — в редких случаях брадикардия, гипотония; при передозировке физостигмина либо при слишком быстром его введении — приступы бронхиальной астмы, блокада сердца и острый инфаркт миокарда, фибрилляция желудочков. Поэтому ряд авторов рекомендуют использовать физостигмин только при выраженном и тяжело протекающем антихолинергическом синдроме и лишь после налаженного мониторинга сердечной деятельности. Часто подчёркивается недопустимость назначения этого препарата при нарушениях сердечной проводимости[1].
Некоторые авторы упоминают об опасности применения физостигмина у коматозных больных, другие, напротив, указывают на эффективность препарата в случаях комы. Высказывается и мнение, что рутинное (шаблонное) применение физостигмина для диагностики и лечения антихолинергического синдрома не вполне оправдано и не очень разумно. В некоторых публикациях использование физостигмина рекомендуется лишь как последняя мера[1].
В публикации R. C. W. Hall с соавторами (1981) приведен следующий список противопоказаний для применения физостигмина: сахарный диабет, гангрена, ренальная гипертензия, ишемическая болезнь сердца, нарушения внутрисердечной проводимости, аритмии, гипотиреоз и гипертиреоз, бронхиты, бронхиальная астма, пептическая язва, колит, обструкция мочевыводящих путей, глаукома, беременность, миотония, ваготония. По данным, приводимым Р. Шейдером с соавторами (1998), а также указанным в других источниках, противопоказаниями являются заболевания сердца и периферических сосудов, бронхоспазм, кишечная непроходимость, обструкция мочевых путей[1]. Упоминаются в источниках и такие противопоказания, как свежий инсульт, отравление арилфосфатами[2].
Для снятия токсических эффектов физостигмина можно применять введение атропина в дозе 0,5 мг на каждый 1 мг физостигмина[1] или холинолитик гликопирролат, который не проникает через гемато-энцефалический барьер и устраняет периферические побочные эффекты физостигмина[2].
Проблема лечения антихолинергического синдрома в России состоит в отсутствии регистрации физостигмина; вместо него можно применять другой ингибитор холинэстеразы — галантамин. От препарата со сходным действием — неостигмина метилсульфата (прозерина) он отличается более медленным развитием терапевтического эффекта и существенно большей стоимостью, но, в отличие от прозерина, может проникать через гемато-энцефалический барьер и поэтому способен устранять не только периферические, но и центральные антихолинергические эффекты[2].
Во всех случаях при антихолинергическом синдроме желательна консультация токсиколога, особенно если предполагается применение физостигмина. При возникновении АХС вследствие приёма прописанных лекарственных средств нужно наладить контакт с врачом, лечившим пациента[1].
После исчезновения выраженных признаков антихолинергического синдрома наблюдение за пациентом в условиях специализированного стационара нужно продолжать как минимум 4 часа, причём лечебные мероприятия в этот период проводить не следует, но следует вести всю необходимую медицинскую документацию. После перенесенного АХС пациентам нужно выдавать специальный «анестезиологический паспорт»[1].
Профилактика
Для профилактики синдрома важно повышение осведомлённости медицинского персонала об этой проблеме и высокая настороженность в отношении АХС.
При применении сочетания препаратов необходимо избегать комбинации лекарств, обладающих холинолитическими свойствами.
Для профилактики возникновения АХС после операции следует вводить физостигмин ещё во время проведения анестезиологических процедур. Физостигмин сокращает время пробуждения после анестезии.
При отравлении холинолитическими средствами риск развития антихолинергического синдрома снижает рибоксин.
Возникновение АХС у детей вследствие случайного отравления можно предотвратить при безопасном хранении медикаментов в домашних условиях.
Врачи, пострадавшие лица и общественность должны сообщать о нежелательных реакциях на продукты растительного происхождения в органы здравоохранения.
Примечания
- Волков В.П. Ятрогенные психонейросоматические синдромы. — Тверь: Триада, 2014. — С. 91—114. — 320 с.
- Данилов М.С., Лебединский К.М. Центральный антихолинергический... синдром? // Анестезиология и реаниматология. — 2015. — Т. 60, вып. № 6.