Цианид аммония
Цианид аммония — неорганическое химическое соединение, соль аммония и синильной кислоты с формулой NH4CN, бесцветные кристаллы, растворяется в воде. Весьма токсичен.
| Цианид аммония | |
|---|---|
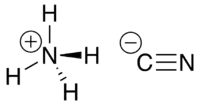 | |
| Общие | |
| Систематическое наименование |
Цианид аммония |
| Традиционные названия | цианид аммония, цианистый аммоний |
| Хим. формула | NH4CN |
| Рац. формула | NH4CN |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 44,06 г/моль |
| Плотность | 4,4 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 36 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | растворяется |
| • в этаноле | растворяется |
| Классификация | |
| Рег. номер CAS | 12211-52-8 |
| PubChem | 159440 |
| SMILES | |
| InChI | |
| ChemSpider | 140210 |
| Безопасность | |
| Предельная концентрация | 0,3 мг/м³ |
| ЛД50 | 14,67 мг/кг |
| Токсичность | чрезвычайно токсичен |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Пропускание цианистого водорода через раствор аммиака, или при пропускании через раскалённый уголь аммиака так же образуется цианистый аммоний:
- Обменными реакциями:
Физические свойства
Цианид аммония образует бесцветные кристаллы тетрагональной сингонии, пространственная группа P 42/mcm, параметры ячейки a = 0,416 нм, c = 0,761 нм, Z = 8.
Растворяется в холодной воде, полностью гидролизуется в горячей. Раствор имеет слабощелочную реакцию.
Химические свойства
- Разлагается при незначительном нагревании:
Применение
- Реагент в органическом синтезе.
Биологическая роль
Цианид аммония, как и все цианиды, чрезвычайно ядовит. ЛД50 на крысах - 14,67 мг/кг при пероральном введении. ПДК в рабочей зоне - 0,3 мг/м³ в пересчёте на HCN.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
