Фотофосфорилирование
Фотофосфорили́рование — процесс синтеза АТФ из АДФ за счёт энергии света. Как и в случае окислительного фосфорилирования, энергия света расходуется на создание протонного градиента на мембране тилакоидов или клеточной мембране бактерии, который затем используется АТФ-синтазой. Фотофосфорилирование — очень древняя форма фотосинтеза, которая есть у всех фототрофных эукариот, бактерий и архей. Различают два типа фосфорилирования — циклическое, сопряжённое с циклическим потоком электронов в электрон-транспортной цепи, и нециклическое, сопряжённое с прямым потоком электронов от H2O к НАДФ+ в случае эукариот или другого донора электрона в случае бактерий, например, H2S. Как разновидность нециклического типа выделяют псевдоциклическое фотофосфорилирование, при котором акцептором электронов служит кислород.
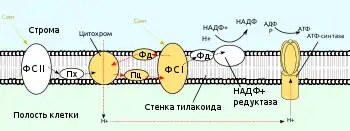
Нециклическое фотофосфорилирование
| H2O | → | Фотосистема II | → | QH2 | → | Цит. b6f | → | Pc | → | Фотосистема I | → | НАДФН |
Нециклическое фотофосфорилирование было открыто Д. Арноном в 1957 году. По сути, это нормальный ход световых реакций фотосинтеза, когда электрон от воды через цепочку мембранных и белковых переносчиков переходит к НАДФ+. Нециклический тип фотофосфорилирования, происходящий при оксигенном фотосинтезе — эволюционно более поздний процесс, который требует совместного действия двух фотосистем. Энергия света, поглощаемая двумя фотосистемами, расходуется на отрыв электронов от воды (фотосистема II, ФСII), а затем (фотосистема I, ФСI) на увеличение его энергии до того состояния, когда он становится способен восстановить ферредоксин и НАДФ+. В ходе этого процесса энергия электрона, полученная им от поглощения фотонов, частично расходуется на перекачку протонов и создание протонного градиента за счёт работы двух протонных помп: цитохром-b6f-комплекса и отчасти фотосистемы II. В результате энергия запасается не только в макроэргических связях АТФ, но и расходуется на создание химического потенциала восстановительных эквивалентов[1].
Физиологическое значение нециклического фотофосфорилирования определяется его ведущим вкладом в энергетику клетки. Оно не только является основным источником энергии для всех реакций, протекающих в клетке, но и поставляет очень важные метаболиты, в первую очередь, высоковосстановленный ферредоксин и НАДФН, необходимые для фиксации CO2 в углеродных циклах и работы ряда регуляторных систем (ферредоксин-тиоредоксиновая регуляторная система)[1].
Циклическое фотофосфорилирование
| НАДФН/Ферредоксин | → | ФНР | → | QH2 | → | Цит. b6f | → | Pc | → | Фотосистема I | → | НАДФН |
Циклическое фотофосфорилирование — один из наиболее древних процессов запасания энергии в форме АТФ. При таком режиме фотофосфорилирования электрон движется по циклической цепи переноса электронов, сопряжённой с фотосистемой I. При этом электрон циркулирует по замкнутому пути, а вся энергия расходуется только на синтез АТФ[2].
При циклическом фотофосфорилировании электрон, перенесённый с фотосистемы I на НАДФН и далее перенесённый с НАДФН на ферредоксин, неким образом перемещается от восстановленного ферредоксина на пул пластохинона. Точный механизм этого процесса не известен. Полагают, что эту реакцию осуществляет особый фермент — ферредоксин-пластохинон-оксидоредуктаза. Затем от пластохинона через цитохром b6f-комплекс и пластоцианин электрон вновь попадает на фотосистему I. При этом происходит закачка протонов в полость тилакоида; когда протоны возвращаются из люмена обратно в строму хлоропласта, они проходят по специальному каналу внутри АТФ-синтазы, что сопровождается синтезом АТФ. В качестве наиболее вероятного кандидата на роль ферредоксин-пластохинон-оксидоредуктазы в последнее время рассматривают ферредоксин-НАДФ+-редуктазу, которая может образовывать комплекс с цитохром-b6f-комплексом. Предполагается, что она может переносить электроны с ферредоксина напрямую на пластохинон, связанный с цитохром-b6f-комплексом через специальный гем cn[3][4]. Большое количество данных также говорит в пользу образования суперкомплекса из цитохром-b6f-комплекса, фотосистемы I, ферредоксин-НАДФ+-редуктазы и трансмембранного белка PGRL1. Образование и распад такого комплекса, как полагают, переключает режим потока электрона с нециклического на циклический и обратно[5][6].
Ещё один фермент, возможно, принимающий участие в этом процессе — это НАДН-дегидрогеназный комплекс хлоропластов, аналогичный НАДH-дегидрогеназному комплексу митохондрий и гомологичный бактериальному комплексу I[7][8]. Он окисляет ферредоксин и передаёт электроны на пластохинон, предотвращая окислительный стресс. НАДН-дегидрогеназный комплекс хлоропластов образует суперкомплекс по крайней мере с двумя ФСI при помощи белков Lhca5 и Lhca6[9]. Протонный градиент, созданный в результате циклического фотофосфорилирования на мембране тилакоида, используется белками-переносчиками для встраивания в мембрану приходящих из стромы белков[10][11].
Циклическое фотофосфорилирование играет важную роль в различных метаболических процессах клетки. Оно служит источником дополнительного снабжения АТФ для восстановления СО2 в цикле Кальвина и ассимиляции ионов NH4+, требующих высокого отношения АТФ/НАДФН, а также источником энергии для анаболических процессов. У группы С4-растений в клетках обкладки проводящего пучка циклическое фотофосфорилирование является единственным источником АТФ. Исследования также показали увеличение активности циклического фотофосфорилирования и его защитную роль в стрессовых условиях (тепловой и солевой стрессы, фотоингибирование)[2].
Псевдоциклическое фосфорилирование
При очень активном восстановлении пула ферредоксина происходит перенос электронов с ферредоксина на О2 с образованием H2O (так называемая реакция Мелера). Он сходен с циклическим транспортом тем, что в ходе этого процесса не синтезируется НАДФН, а только АТФ. Однако в условиях реакции Мелера соотношение АТФ/АДФ очень велико, так что имеющегося количества АДФ недостаточно для синтеза АТФ, и, как следствие, на мембране тилакоида создаётся очень высокий протонный градиент. В результате реакции происходит образование супероксид-анион-радикала O2-·, который превращается в O2 и H2O2 под воздействием фермента супероксиддисмутазы, а перекись превращается в воду ферментом аскорбатпероксидазой[12].
Ещё один фермент, участвующий в псевдоциклическом транспорте, — терминальная оксидаза хлоропластов, гомологичная альтернативной оксидазе растительных митохондрий. Она окисляет пул пластохинона с участием кислорода, образуя воду и рассеивая энергию в форме тепла[13].
Бактерии и археи
Фотосинтезирующие бактерии способны осуществлять фотофосфорилирование (как циклическое, так и нециклическое), однако у них присутствует только один фотосинтетический реакционный центр, схожий по строению с фотосистемой I или II высших растений. Поскольку такие бактерии не могут использовать воду как неисчерпаемый источник электронов, в процессе бактериального фотосинтеза не выделяется кислород, и такой фотосинтез является аноксигенным. Бактерии, осуществляющие нециклическое фотофосфорилирование, используют в качестве доноров восстановительных эквивалентов (то есть, электронов или атомов водорода) сероводород или другие соединения серы. Исключением являются цианобактерии, которые обладают двумя фотосистемами и способны осуществлять оксигенный фотосинтез подобно водорослям и высшим растениям.
Пурпурные бактерии
Пурпурные бактерии используют одну фотосистему, схожую по строению с ФСII растений и цианобактерий, но вместо хлорофиллов она несёт бактериохлорофиллы, а первичным акцептором электрона служит бактериофеофитин.
| цит. с2 | → | Фотосистема П680 | → | QH2 | → | Цит. bс | → | цит. с2 |
Единственный тип фотофосфорилирования, доступный этим бактериям, — циклическое фотофосфорилирование. Возбуждённый электрон от главного пигмента П680 поступает на бактериофеофитин, а оттуда на мембранный переносчик — хинон, который поступает в бактериальный цитохром-bc1-комплекс. Отсюда электрон поступает на растворимый переносчик — цитохром с2, который вновь возвращает его к реакционному центру. За счёт работы мембранных комплексов генерируется протонный градиент и может идти синтез АТФ, однако не происходит синтеза восстановительного эквивалента НАДН. Чтобы их синтезировать, необходимо использовать или молекулярный водород, или сероводород, которые могут напрямую восстановить НАД+. Для этих же целей часто используется окисление присутствующих в среде органических веществ[14]. Кроме того, возможен обратный перенос электронов на ферредоксин с затратой АТФ, который идёт с уровня FeS-белка цитохром-bc1-комплекса[14].
Зелёные серобактерии и гелиобактерии
Зелёные серобактерии подразделяются на серных и несерных зелёных бактерий. Они используют реакционный центр схожий с ФСI растений, в котором первичным акцептором электрона является бактериохлорофилл. Им свойственна следующая схема фотосинтеза:
| H2S, S0, S2O32- | → | Фотосистема П840 | → | ферредоксин | → | НАДФН |
| ферредоксин | → | менахинон | → | Цит. bс | → | цитохром с553 | → | Фотосистема П840 | → | ферредоксин |
Из схемы видно, что восстановительные эквиваленты могут синтезироваться путём простого нециклического переноса от ферредоксина, если в системе есть внешние доноры электронов (H2S, S0, S2O32- и др.). Электроны поступают в цепь через восстановление менахинона или цитохрома с553. Однако нециклический поток электронов не вносит вклад в синтез АТФ, так как реакционный центр типа фотосистемы I не перекачивает протоны. Таким образом, зелёные серобактерии обладают только циклическим фотофосфорилированием, в которое вовлечён цитохром-bc1-комплекс. Любопытно, что по своей схеме циклическое фотофосфорилирование этих организмов очень схоже с таковым у высших растений и включает перенос электрона с ферредоксина на мембранный переносчик менахинон. Вышеописанная принципиальная схема фотосинтеза характерна для ещё одной группы фототрофных организмов — гелиобактерий[14]. В отличие от зелёных серобактерий, гелиобактерии в качестве донора электронов испоьзуют только органические вещества (например, пируват)[15].
Галоархеи
Особый случай фотофосфорилирования представляет собой фотофосфорилирование галоархей, которые создают протонный градиент на основе энергии света без использования типичных фотосистем или электрон-транспортных цепей. Вместо этого в их мембранах присутствует специальный белок — бактериородопсин, который в качестве кофактора несёт ковалентно связанный ретиналь. Поглотив фотон, ретиналь переходит из транс- в 13-цис-форму. При этом он изгибается и переносит протон с одного конца белка на другой. Далее ретиналь разгибается и возвращается в начальное положение, но уже без протона[16].
Примечания
- Ермаков, 2005, с. 186.
- Ермаков, 2005, с. 185.
- Cramer WA.; Zhang H.; Yan j.; Kurisu G.; Smith JL. Transmembrane traffic in the cytochrome b6f complex. (англ.) // Annu Rev Biochem : journal. — 2006. — Vol. 75. — P. 769—790. — doi:10.1146/annurev.biochem.75.103004.142756. — PMID 16756511.
- Cramer WA.; Yan J.; Zhang H.; Kurisu G.; Smith JL. Structure of the cytochrome b6f complex: new prosthetic groups, Q-space, and the 'hors d'oeuvres hypothesis' for assembly of the complex. (англ.) // Photosynth Res : journal. — 2005. — Vol. 85, no. 1. — P. 133—143. — doi:10.1007/s11120-004-2149-5. — PMID 15977064.
- Masakazu Iwai, Kenji Takizawa, Ryutaro Tokutsu, Akira Okamuro, Yuichiro Takahashi & Jun Minagawa. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis (англ.) // Nature : journal. — 2010. — 22 April (vol. 464). — P. 1210—1213. — doi:10.1038/nature08885.
- Hiroko Takahashi, Sophie Clowez, Francis-André Wollman, Olivier Vallon & Fabrice Rappaport. Cyclic electron flow is redox-controlled but independent of state transition (англ.) // Nature Communications : journal. — Nature Publishing Group, 2013. — 13 June (vol. 4). — doi:10.1038/ncomms2954.
- Lianwei Peng, Hideyuki Shimizu, Toshiharu Shikanai,. The Chloroplast NAD(P)H Dehydrogenase Complex Interacts with Photosystem I in Arabidopsis. (англ.) // J Biol Chem. : journal. — 2008. — Vol. 283, no. 50. — P. 34873—34879.. — doi:10.1074/jbc.M803207200.
- Yamori W., Sakata N., Suzuki Y., Shikanai T., Makino A. Cyclic electron flow around photosystem I via chloroplast NAD(P)H dehydrogenase (NDH) complex performs a significant physiological role during photosynthesis and plant growth at low temperature in rice. (англ.) // Plant J. : journal. — 2011. — Vol. 68, no. 6. — P. 966—976. — doi:10.1111/j.1365-313X.2011.04747.x.
- Lianwei Peng, Hiroshi Yamamoto, Toshiharu Shikanai. Structure and biogenesis of the chloroplast NAD(P)H dehydrogenase complex. (англ.) // Biochimica et Biophysica Acta (BBA) : journal. — 2011. — Vol. 1807, no. 8. — P. 945—953. — doi:10.1016/j.bbabio.2010.10.015.
- Chaddock, A.M.; Mant, A.; Karnauchov, I.; Brink, S.; Herrmann, R.G.; Klösgen, R.B.; Robinson, C. A new type of signal peptide: central role of a twin-arginine motif in transfer signals for the delta pH-dependent thylakoidal protein translocase. (англ.) // EMBO J. : journal. — 1995. — Vol. 14, no. 12. — P. 2715—2722. — PMID 7796800.
- Kenneth Cline and Hiroki Mori. Thylakoid ΔpH-dependent precursor proteins bind to a cpTatC–Hcf106 complex before Tha4-dependent transport. (англ.) // J Cell Biol. : journal. — 2001. — 20 August (vol. 154, no. 4). — P. 719—730. — doi:10.1083/jcb.200105149.
- Страсбургер, 2008, с. 117.
- McDonald A.E., Ivanov A.G., Bode R., Maxwell D.P., Rodermel S.R., Hüner N.P. Flexibility in photosynthetic electron transport: the physiological role of plastoquinol terminal oxidase (PTOX) (англ.) // Biochim. Biophys. Acta : journal. — 2011. — August (vol. 1807, no. 8). — P. 954—967. — doi:10.1016/j.bbabio.2010.10.024. — PMID 21056542.
- Нетрусов, Котова, 2012, с. 186.
- Светособирающие антенны фотосинтеза = Light-Harvesting Antennas in Photosynthesis / Green, Beverley, Parson, W.W.. — Springer-Science+Business Media, B. V., 2003. — Vol. 13. — P. 495. — (Advances in Photosynthesis and Respiration). — ISBN 978-90-481-5468-5.
- Hayashi S., Tajkhorshid E., Schulten K. Molecular dynamics simulation of bacteriorhodopsin's photoisomerization using ab initio forces for the excited chromophore (англ.) // Biophysical Journal : journal. — 2003. — September (vol. 85, no. 3). — P. 1440—1449. — doi:10.1016/S0006-3495(03)74576-7. — PMID 12944261.
Литература
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
- Зитте П. и др. Ботаника / Под ред. В. В. Чуба. — 35-е изд. — М.: Академия, 2008. — Т. 2. Физиология растений. — 495 с.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — С. 46. — 384 с. — ISBN 978-5-7695-7979-0.