Аммоний-катионы
Аммоний-катионы — положительно заряженные ионы аммония с общей химической формулой N+RRlRllRlll, где R,Rl,Rll,Rlll = H, Alk, Ar[1][2].
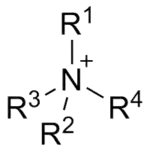
Аммоний-катионы можно рассматривать как продукты замещения атомов водорода аммоний-катиона NH4+ на органические радикалы (Alk, Ar).
По числу замещённых атомов водорода (1,2,3 или 4) различают, соответственно, первичные, вторичные, третичные и четвертичные аммоний-катионы (рис.1).
Простейший аммоний-катион NH4+ образуется по донорно-акцепторному механизму путём присоединения протона к аммиаку:
Поставщиком протонов являются минеральные (неорганические) и органические кислоты. Продуктами взаимодействия аммиака и кислот являются соли аммония.
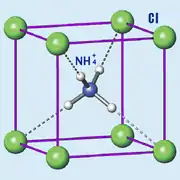
В аммоний-катионе NH4+ все четыре связи равноценны и неразличимы, поэтому считается что электрический заряд в катионе делокализован (рассредоточен) по всему комплексу. Размер аммоний-катиона NH4+ составляет 1,43 Å[3]. В кристалле хлорида аммония аммоний-катион NH4+ окружают восемь ионов хлора (рис.2). Параметр кристаллической решётки 3,8758 Å.[4].
Замещённые аммоний-катионы также образуются по донорно-акцепторному механизму путём присоединения протона к соответствующим аминам.
- Первичные
-
- Вторичные
- Третичные
Четвертичные аммоний-катионы получают главным образом алкилированием третичных аминов (так называемая кватернизация)[1]:
Многие четвертичные аммониевые соединения биологически активны, встречаются в природе (наиболее важные из них — холин и ацетилхолин).[1]
Примечания
- Химический энциклопедический словарь / гл.ред. И.Л.Кнунянц. — М.: Сов. энциклопедия, 1983. — С. 41-43. — 792 с.
- Химическая энциклопедия / гл.ред. И.Л.Кнунянц. — М.: Сов. энциклопедия, 1988. — Т. 1. — С. 152.
- Ахметов Н.С. Неорганическая химия. — 2-е перераб. и доп.. — М.: Высшая школа, 1975. — С. 394. — 672 с.
- Справочник химика. — 2-е изд. перераб. и доп.. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 470. — 1072 с.