Рамановская спектроскопия
Рамановская спектроскопия или спектроскопия комбинационного рассеяния — это спектроскопический метод исследования используемый для определения колебательных мод молекул и вибрационных мод в твёрдых телах, который также служит для определения вращательных и другие низкочастотных мод систем[1]. Рамановская спектроскопия обычно используется в химии для получения структурных отпечатков пальцев, по которым можно идентифицировать молекулы..Метод назван в честь индийского физика Ч. В. Рамана.
Рамановская спектроскопия основана на неупругом рассеянии фотонов, известном как комбинационное рассеяние. В современных спектрометрах используется источник монохроматического света, обычно от лазера в видимом, ближнем инфракрасном или ближнем ультрафиолетовом диапазоне, хотя также можно использовать рентгеновские лучи. Лазерный свет взаимодействует с колебаниями атомов в молекулах, фононами или другими возбуждениями в системе, в результате чего энергия лазерных фотонов смещается в область высоких или низких значений. Сдвиг энергии даёт информацию о колебательных модах в системе. Инфракрасная спектроскопия обычно даёт аналогичную, но и дополнительную информацию.
При измерениях спектра образец освещается лазерным лучом. Электромагнитное излучение от освещённого пятна собирается линзой и проходит через монохроматор. Упругое рассеянное излучение на длине волны, соответствующей лазерной линии (рэлеевское рассеяние), отфильтровывается либо режекторным фильтром, либо краевым фильтром, либо полосовым фильтром, в то время как остальная часть собранного света попадает в детектор.
Спонтанное комбинационное рассеяние света обычно очень слабое; в результате в течение многих лет основная трудность при измерении спектров комбинационного рассеяния заключалась в разделении слабого неупруго-рассеянного света от интенсивного рэлеевского рассеянного лазерного света (так называемое «подавление лазерного излучения»). Исторически сложилось так, что рамановские спектрометры использовали голографические решётки и нескольких ступеней дисперсии для достижения высокой степени подавления лазерного излучения. В прошлом использовались фотоумножители в качестве детекторов для систем с дисперсионным комбинационным рассеиванием, что приводило к длительному времени сбора данных. Однако в современных приборах почти повсеместно используются режекторные или краевые фильтры для подавления лазерного излучения. Сейчас дисперсионные одноступенчатые спектрографы (аксиально-пропускающие или монохроматоры Черни-Тёрнера) в паре с детекторами ПЗС наиболее распространены, хотя спектрометры с преобразованием Фурье также используются с инфракрасными лазерами.
Название «рамановская спектроскопия» обычно относится к колебательному комбинационному излучению с использованием длин волн лазера, которые не поглощаются образцом. Существует множество других вариаций рамановской спектроскопии: поверхностно-усиленная рамановская спектроскопия, резонансное комбинационное рассеяние света, когерентная анти-стоксовая рамановская спектроскопия, спектроскопия комбинационного рассеяния с усилением наконечника, поляризованное комбинационное рассеяние, вынужденное комбинационное рассеяние, комбинационное рассеяние света с пропусканием, комбинационное рассеяние с пространственным смещением и гиперкомбинационное рассеяние.
Теория
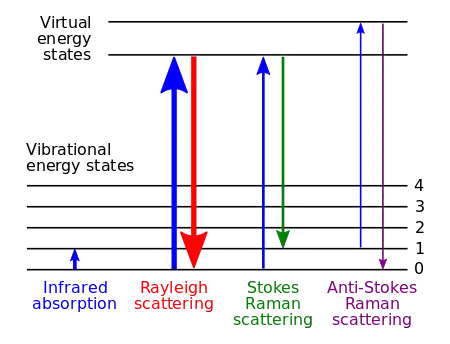
Величина эффекта комбинационного рассеяния коррелирует с поляризуемостью электронных облаков в молекуле. Это форма неупругого рассеяния света, когда фотон возбуждает образец, то есть переводит молекулу в состояние с виртуальной энергией на короткое время перед испусканием фотона. Неупругое рассеяние означает, что энергия испускаемого фотона либо ниже, либо выше, чем энергия падающего фотона. После события рассеяния молекула находится в другом вращательном или колебательном состоянии.
Чтобы полная энергия системы оставалась постоянной после того, как молекула переходит в новое ровибронное (вращательно-колебательно-электронное) состояние, рассеянный фотон изменяет свою энергию и, следовательно частоту. Эта разность энергий соответствует разнице между начальным и конечным ровибронными состояниями молекулы. Если конечное состояние имеет более высокую энергию, чем начальное состояние, то рассеянный фотон будет смещён в состояние с низкой частотой (более низкую энергию), так что полная энергия останется прежней. Этот сдвиг частоты называется стоксовым сдвигом или понижением частоты. Если конечное состояние имеет более низкую энергию, то рассеянный фотон перейдёт св состояние с более высокой частотой, что называется антистоксовым сдвигом или повышением частоты.
Для того чтобы молекула проявляла эффект комбинационного рассеяния, необходимо изменить её диполь-дипольную поляризуемость относительно переменной координаты, соответствующей ровибронному состоянию. Интенсивность комбинационного рассеяния света пропорциональна этому изменению поляризуемости. Следовательно, спектр комбинационного рассеяния (интенсивность рассеяния как функция частотных сдвигов) зависит от ровибронных состояний молекулы.
Эффект комбинационного рассеяния основан на взаимодействии между электронным облаком образца и внешним электрическим полем монохроматического света, которое может создавать индуцированный дипольный момент внутри молекулы на основе её поляризуемости. Поскольку лазерный свет не возбуждает молекулу, реального перехода между уровнями энергии не происходит[2]. Эффект комбинационного рассеяния не следует путать с излучением (флуоресценцией или фосфоресценцией), при котором молекула в возбуждённом электронном состоянии излучает фотон и возвращается в основное электронное состояние, во многих случаях из колебательно-возбуждённого состояния на поверхность постоянной потенциальной энергии основного электронного состояния. Рамановское рассеяние также контрастирует с поглощением в инфракрасном (ИК) диапазоне, когда энергия поглощённого фотона соответствует разнице в энергии между начальным и конечным ровибронными состояниями. Зависимость комбинационного рассеяния от производной диполь-дипольной поляризуемости также отличается от ИК-спектроскопии, которая зависит от производной электрического дипольного момента, тензора поляризации атомов. Эта контрастирующая особенность позволяет анализировать ровибронные переходы, которые могут не быть активными в ИК-диапазоне, с помощью спектроскопии комбинационного рассеяния, что демонстрируется правилом взаимного исключения в слчаецентросимметричных молекул. Переходы, которые имеют большую интенсивность комбинационного рассеяния, часто имеют слабую ИК-интенсивность, и наоборот. Если связь сильно поляризована, небольшое изменение её длины, которое происходит во время вибрации, имеет лишь небольшое влияние на поляризацию. Колебания с участием полярных связей (например, CO, NO, OH), следовательно, являются сравнительно слабыми рамановскими рассеивателями. Однако такие поляризованные связи несут свои электрические заряды во время колебательного движения (если не нейтрализованы факторами симметрии), и это приводит к большему изменению суммарного дипольного момента во время колебания, создавая сильную полосу ИК-поглощения. И наоборот, относительно нейтральные связи (например, CC, CH, C = C) испытывают большие изменения поляризуемости во время вибрации. Однако на дипольный момент не влияет аналогичным образом, так что, хотя колебания, включающие преимущественно этот тип связи, являются сильными рамановскими рассеивателями, они являются слабыми в ИК-диапазоне. Третий метод колебательной спектроскопии, неупругое некогерентное рассеяние нейтронов (IINS), можно использовать для определения частот колебаний в высокосимметричных молекулах, которые могут быть неактивными как в инфракрасном, так и в рамановском диапазонах. Правила выбора IINS или разрешённые переходы отличаются от правил IR и рамана, поэтому эти три метода дополняют друг друга. Все они дают одинаковую частоту для данного колебательного перехода, но относительные интенсивности предоставляют разную информацию из-за разных типов взаимодействия между молекулой и падающими частицами, фотонами для ИК и комбинационного рассеяния света и нейтронами для IINS.
История

Хотя неупругое рассеяние света было предсказано Адольфом Смекалем в 1923 году[4] на практике оно не наблюдалось до 1928 года. Эффект Рамана был назван в честь одного из его первооткрывателей, индийского ученого К. В. Рамана, который наблюдал этот эффект в органических жидкостях в 1928 году вместе со своим учеником К. С. Кришнаном, а также независимо от них в Советском Союзе Григорием Ландсбергом и Леонидом Мандельштамом в неорганических кристаллах[1]. Раман получил Нобелевскую премию по физике в 1930 году за это открытие. Первое наблюдение спектров комбинационного рассеяния в газах произошло в 1929 году Франко Разетти[5].
Систематическая новаторская теория эффекта комбинационного рассеяния была разработана чехословацким физиком Джорджем Плачеком между 1930 и 1934 годами[6]. Вначале ртутная дуга использовалась стала в качестве основного источника света, а для записи спектра — фотография, и позже — спектрофотометрические методы.
Спустя годы после открытия, спектроскопия комбинационного рассеяния использовалась для получения первого каталога частот молекулярных колебаний. Обычно образец помещался в длинную трубку и освещался по всей её длине пучком отфильтрованного монохроматического света, генерируемого газоразрядной лампой. Фотоны, рассеянные образцом, собирались через интерферометр для контроля формы и чистоты поверхности на конце трубки. Чтобы максимизировать чувствительность, образец имел высокую концентрироцию (1 М или более) и использовались относительно большие объёмы (5 мл или более).
Рамановский сдвиг
Рамановские сдвиги обычно выражаются в волновых числах, которые имеют размерность обратной длины, поскольку это значение напрямую связано с энергией. Для преобразования между спектральной длиной волны и волновыми числами сдвига в спектре комбинационного рассеяния можно использовать следующую формулу:
где Δν̃ — рамановский сдвиг, выраженный в волновом числе, λ0 — длина волны возбуждения, а λ1 — длина волны рамановского спектра. Чаще всего единицей измерения, выбранной для выражения волнового числа в спектрах комбинационного рассеяния, является обратный сантиметр (см−1). Поскольку длина волны часто выражается в нанометрах (нм), приведёную выше формулу можно переписать для этих единиц в явном виде
Приборы
_(2019)_1662-1683.png.webp)
В современной рамановской спектроскопии почти всегда используются лазеры в качестве источника света. Поскольку лазеры не были доступны более трёх десятилетий после открытия эффекта, Раман и Кришнан использовали ртутную лампу и фотографические пластинки для записи спектров. Для получения ранних спектров требовались часы или даже дни из-за слабых интенсивностей источников света, плохой чувствительности детекторов и малых сечений рамановского рассеяния большинства материалов. Для выбора определённых диапазонов длин волн для возбуждения и детектирования использовались различные цветные фильтры и химические растворы, но в фотографических спектрах всё ещё преобладала широкая центральная линия, соответствующая рэлеевскому рассеянию источника возбуждения[9].
Технологические достижения сделали рамановскую спектроскопию намного более чувствительной, особенно с 1980-х годов. Наиболее распространёнными современными детекторами в настоящее время являются приборы с зарядовой связью (ПЗС). Матрицы фотодиодов и фотоэлектронные умножители использовались до внедрения ПЗС-матриц. Также влияние оказало появление надёжных, стабильных и недорогих лазеров с узкой полосой пропускания[10].
Лазеры
Рамановская спектроскопия требует источника света, такого как лазер. Разрешение спектра зависит от ширины полосы используемого лазерного источника[11]. Обычно более коротковолновые лазеры дают более сильное комбинационное рассеяние из-за частотной зависимости ν4 поперечных сечений комбинационного рассеяния, но могут возникнуть проблемы с деградацией образца или флуоресценцией[10].
Непрерывные лазеры првалируют в нормальной рамановской спектроскопии, но могут использоваться также импульсные лазеры. Они часто имеют более широкую полосу пропускания, чем работающие в непрерывном режиме, но очень полезны для других форм рамановской спектроскопии, таких как нестационарная, временная и резонансная рамановская спектроскопия[11][12].
Детекторы
Рамановский рассеянный свет обычно собирается и либо рассеивается спектрографом, либо используется совместно с интерферометром для детектирования методами преобразования Фурье (FT). Во многих случаях имеющиеся в продаже ИК Фурье-спектрометры можно модифицировать для применения комбинационного рассеяния Фурье[10].
Детекторы для дисперсионного комбинационного рассеяния света
В большинстве случаев современные рамановские спектрометры используют матричные детекторы, такие как ПЗС-матрицы. Существуют различные типы ПЗС-матриц, оптимизированные для различных диапазонов длин волн. ПЗС-матрицы с усиленным диапазоном используются для очень слабых сигналов и импульсных лазеров[10][13]. Спектральный диапазон зависит от размера ПЗС и фокусного расстояния используемого спектрографа[14].
Раньше часто использовались монохроматоры, соединённые с фотоумножителями. В этом случае монохроматор необходимо ьыло перемещать, чтобы сканировать весь интересующий спектральный диапазон[10].
Детекторы для Фурье-спектрометра
Фурье-рамановские спектрометры почти всегда используется с лазерами ближнего инфракрасного диапазона, и в зависимости от длины волны возбуждения соответствующими детекторами. Обычно используются детекторы на основе германия или индия-галлия (InGaAs)[10].
Фильтры
Чтобы отделить рамановский рассеянный свет от рэлеевского сигнала и отражённого лазерного сигнала, и получить высококачественные рамановские спектры, используются режекторные или фильтры низких частот. До появления голографических фильтров было принято использовать монохроматор с тройной дифракционной решёткой в режиме вычитания для выделения полезного сигнала[10]. Этот метод всё ещё можно использовать для записи очень малых рамановских сдвигов, поскольку голографические фильтры обычно отражают некоторые из низкочастотных полос в дополнение к несмещённому лазерному свету. Тем не менее, фильтры на основе объёмной голограммы становятся всё более распространёнными, потому что позволяют регистрировать сдвиги всего на 5 см−1[15][16][17].
Приложения
Рамановская спектроскопия используется в химии для идентификации молекул и изучения химической связи и внутримолекулярных связей. Поскольку частоты колебаний зависят от химических связей и симметрии молекулы (область определения органических молекул находится в диапазоне волновых чисел 500—1500 см−1)[18], раман даёт возможность для идентификации молекул. Например, спектры комбинационного рассеяния и ИК-спектры использовались для определения частот колебаний SiO, Si2O2 и Si3O3 на основе анализа нормальных координат[19]. Раман также используется для изучения добавок субстрата к ферменту.
В физике твёрдого тела спектроскопия комбинационного рассеяния используется для характеристики материалов, измерения температуры и определения кристаллографической ориентации образца. Как и одиночные молекулы, твёрдый материал можно идентифицировать по характерным фононным модам. Информация о заселённости фононной моды даётся соотношением стоксовой и антистоксовой интенсивностей спонтанного рамановского сигнала. Рамановская спектроскопия также может использоваться для наблюдения других низкочастотных возбуждений твёрдого тела, таких как плазмоны, магноны и сверхпроводящие щелевые возбуждения. Волоконно-оптическое измерение температуры использует рамановское обратное рассеяние лазерных импульсов для определения распределения температуры вдоль оптических волокон. Ориентацию анизотропного кристалла можно определить по поляризации комбинационно-рассеянного света по отношению к кристаллу и поляризации лазерного света, если точечная группа кристаллической структуры известна.
В нанотехнологии рамановский микроскоп можно использовать для анализа нанопроволок, чтобы лучше понять их структуру, а режим радиальных вибраций углеродных нанотрубок обычно используется для оценки их диаметра.
Рамановские активные волокна, такие как арамид и карбон, имеют колебательные моды, которые показывают сдвиг частоты комбинационного рассеяния под действием приложенного напряжения. Полипропиленовые волокна демонстрируют аналогичные сдвиги.
В химии твёрдого тела и биофармацевтической промышленности спектроскопия комбинационного рассеяния может использоваться не только для идентификации активных фармацевтических ингредиентов (АФИ), но и для идентификации их полиморфных форм. Например, препарат Cayston (азтреонам), продаваемый компанией Gilead Sciences для лечения муковисцидоза[20], можно идентифицировать и охарактеризовать с помощью ИК-спектроскопии и спектроскопии комбинационного рассеяния. Использование правильной полиморфной формы в биофармацевтических препаратах имеет решающее значение, поскольку разные формы имеют разные физические свойства, такие как растворимость и температура плавления.
Спектроскопия комбинационного рассеяния находит широкое применение в биологии и медицине. Она помогла подтвердить существование низкочастотных фононов[21] в белках и ДНК[22][23][24][25], способствуя изучению низкочастотного коллективного движения в белках и ДНК и их биологических функций[26][27]. Репортерные молекулы для комбинационного рассеяния с олефиновыми или алкиновыми фрагментами разрабатываются для визуализации тканей с помощью SERS-меченых антител[28]. Рамановская спектроскопия также использовалась в качестве неинвазивного метода для биохимической характеристики ран in situ в режиме реального времени. Многофакторный анализ спектров комбинационного рассеяния позволил оценить количествено меру заживления ран[29]. Спектроскопия комбинационного рассеяния с пространственным смещением (SORS), которая менее чувствительна к поверхностным слоям, чем обычная рамановская спектроскопия, может использоваться для обнаружения поддельных лекарств без вскрытия их упаковки, а также для неинвазивного исследования биологических тканей[30]. Огромная причина, по которой рамановская спектроскопия так полезна в биологических приложениях, заключается в том, что её результаты часто не сталкиваются с помехами от молекул воды из-за того, что они имеют постоянные дипольные моменты, и, как следствие, рамановское рассеяние нельзя измерить. Это большое преимущество, особенно для биологических приложений[31]. Рамановская спектроскопия также широко используется для изучения биоминералов[32]. Наконец, газоанализаторы комбинационного рассеяния имеют множество практических применений, включая мониторинг смесей анестетика и респираторного газа в режиме реального времени во время операции.
Рамановская спектроскопия использовалась в нескольких исследовательских проектах как средство обнаружения взрывчатых веществ с безопасного расстояния с помощью лазерных лучей[33][34][35].
Рамановская спектроскопия получает дальнейшее развитие, для возможности использовать её в клинических условиях. Raman4Clinic — европейская организация, работающая над внедрением методов рамановской спектроскопии в медицинскую сферу. Они работают над различными проектами, одним из которых является мониторинг рака с использованием легкодоступных биологических жидкостей, таких как образцы мочи и крови. Этот метод был бы менее стрессовым для пациентов, чем необходимость постоянно делать биопсию, которая не всегда безопасна[36].
Искусство и культурное наследие
Рамановская спектроскопия является эффективным и неразрушающим способом исследования произведений искусства и артефактов культурного наследия, отчасти потому, что это неинвазивный процесс, который можно применять in situ[37]. Его можно использовать для анализа продуктов коррозии на поверхности артефактов (статуй, керамики и т. д.), что может дать представление о коррозионной среде, в которой находятся артефакты. Полученные спектры также можно сравнить со спектрами очищенных или преднамеренно подвергшихся коррозии поверхностей, что может помочь в определении подлинности ценных исторических артефактов[38].
Метод способен идентифицировать отдельные пигменты в картинах и продукты их разложения, что может дать представление о манере работы художника в дополнение к помощи в аутентификации картин[39]. Это также даёт информацию об исходном состоянии картины в тех случаях, когда пигменты деградировали с возрастом[40]. Было показано, что помимо идентификации пигментов обширная рамановская микроскопия обеспечивает доступ к множеству следовых соединений в раннесредневековом пигменте египетском синем (церулеум), что позволяет реконструировать индивидуальную «биографию» красящего вещества, включая информацию о типе и происхождении красителя. сырье, синтезе и нанесении пигмента, старении красочного слоя[41].
В дополнение к картинам и артефактам спектроскопия комбинационного рассеяния может использоваться для исследования химического состава исторических документов (таких как Келлская книга), что может дать представление о социальных и экономических условиях при их создании[42]. Она также даёт неинвазивный способ определения наилучшего метода сохранения или консервации таких артефактов культурного наследия, позволяя понять причины ухудшения состояния[43].
Спектральная база данных IRUG (Infrared and Raman Users Group) представляет собой тщательно рецензируемую онлайн-базу данных эталонных инфракрасных и рамановских спектров для материалов культурного наследия, таких как произведения искусства, архитектуры и археологические артефакты. База данных открыта для ознакомления широкой публики и включает интерактивные спектры для более чем сотни различных типов пигментов и красок[44].
Микроспектроскопия
Спектроскопия комбинационного рассеяния предлагает несколько преимуществ для микроскопического анализа. Поскольку этот метод относится к рассеиванию света, то образцы не нужно фиксировать или делать срезы. Спектры комбинационного рассеяния собирают из очень небольшого объёма (< 1 мкм в диаметре, < 10 мкм в глубину); эти спектры позволяют идентифицировать соединения, присутствующие в этом объёме[45]. Вода обычно не мешает спектральному анализу комбинационного рассеяния. Таким образом, спектроскопия комбинационного рассеяния подходит для микроскопического исследования минералов, материалов, таких как полимеры и керамика, клеток, белков и образцов судебно-медицинской экспертизы. Рамановский микроскоп состоит из стандартного оптического микроскопа и возбуждающего лазера, монохроматора или полихроматора и чувствительного детектора (например, устройства с зарядовой связью (ПЗС) или фотоумножителя (ФЭУ)). Рамановская фурье-спектроскопия также используется с микроскопами, обычно в сочетании с лазерным возбуждением в ближней инфракрасной области (NIR). Ультрафиолетовые микроскопы и оптика с усиленным УФ-излучением должны использоваться, когда источник УФ-лазера применяется для рамановской микроспектроскопии.
При прямой визуализации (также называемой глобальной визуализацией[46] или широкопольным освещением) всё поле зрения исследуется на рассеяние света, интегрированное в небольшом диапазоне волновых чисел (рамановские сдвиги)[47]. Например, волновое число, характерное для холестерина, можно использовать для записи распределения холестерина в клеточной культуре. Этот метод используется для характеристики крупномасштабных устройств, картирования различных соединений и изучения динамики. Он уже использовался для характеристики графеновых слоёв[48], J-агрегированных красителей внутри углеродных нанотрубок[49] и многих других двумерных материалов, таких как MoS2 и WSe2. Поскольку возбуждающий пучок рассеивается во всём поле зрения, эти измерения можно проводить, не повреждая образец.
Наиболее распространённым подходом является гиперспектральная визуализация или химическая визуализация, при которой тысячи рамановских спектров получаются со всего поля зрения, например, путём растрового сканирования образеца сфокусированным лазерным лучом[47]. Данные можно использовать для создания изображений, показывающих расположение и количество различных компонентов. Наличие полной спектроскопической информации, доступной в каждой точке измерения, имеет то преимущество, что одновременно можно картировать несколько компонентов, включая химически сходные и даже полиморфные формы, которые невозможно различить, измеряя только одно волновое число. Кроме того, по гиперспектральным картам можно определить свойства материала, такие как напряжение и деформация, ориентация кристалла, кристалличность и внедрение посторонних ионов в кристаллическую решётку (например, легирование, серия твёрдых растворов)[8]. На примере клеточной культуры гиперспектральное изображение может показать распределение холестерина, а также белков, нуклеиновых и жирных кислот. Сложные методы обработки сигналов и изображений позволяют игнорировать наличие воды, питательных сред, буферных растворов и других помех.
Поскольку рамановский микроскоп представляет собой систему с дифракционным ограничением, его пространственное разрешение зависит от длины волны света, числовой апертуры фокусирующего элемента и — в случае конфокальной микроскопии — от диаметра конфокальной апертуры. При работе в диапазоне от видимого до ближнего инфракрасного рамановский микроскоп может достигать поперечного разрешения около 1 мкм до 250 нм, в зависимости от длины волны и типа объектива (например, линзы с воздушной или водяной или масляной иммерсией). Разрешение по глубине (если оно не ограничено оптическим проникновением в образец) может варьироваться от 1 до 6 мкм с наименьшей апертурой конфокального отверстия до 10 микрометров при работе без конфокального отверстия[50][51][52][45]. В зависимости от образца высокая плотность лазерной мощности из-за микроскопической фокусировки может иметь преимущество в улучшенном фотообесцвечивании молекул, излучающих мешающую флуоресценцию. Однако длина волны лазера и мощность лазера должны быть тщательно подобраны для каждого типа образца, чтобы избежать его разрушения или деградации.
Область применения рамановской визуализации варьируется от материаловедения до биологических исследований[45][53]. Для каждого типа образца параметры измерения должны быть индивидуально оптимизированы. По этой причине современные рамановские микроскопы часто оснащены несколькими лазерами с разными длинами волн, набором объективов и фильтрами нейтральной плотности для настройки мощности лазера, достигающего образца. Выбор длины волны лазера в основном зависит от оптических свойств образца и цели исследования[54]. Например, рамановская микроскопия биологических и медицинских образцов часто выполняется с возбуждением от красного до ближнего инфракрасного диапазона (например, 785 нм, или 1064 длина волны нм). Из-за обычно низкого поглощения биологических образцов в этом спектральном диапазоне снижается риск повреждения образца, а также эмиссия автофлуоресценции, и можно достигнутаь большой глубины проникновения в ткани[55][56][57][58]. Однако интенсивность комбинационного рассеяния на больших длинах волн мала (из-за зависимости интенсивности комбинационного рассеяния от частоты ω4), что приводит к длительному времени сбора данных. С другой стороны, резонансная рамановская визуализация одноклеточных водорослей на 532 нм (зелёный свет) может специально исследовать распределение каротиноидов в клетке с помощью лазера низкой мощности ~ 5 мкВт и всего 100 мс[59].
Рамановское рассеяние, в частности спектроскопия комбинационного рассеяния с усилением на острие, даёт гиперспектральные изображения с высоким разрешением одиночных молекул[60], атомов[61] и ДНК[62].
Поляризационная зависимость комбинационного рассеяния
Рамановское рассеяние чувствительно к поляризации и может предоставить подробную информацию о симметрии активных мод комбинационного рассеяния. В то время как обычная спектроскопия комбинационного рассеяния определяет химический состав, поляризационные эффекты в спектрах комбинационного рассеяния дают информацию об ориентации молекул в монокристаллах и анизотропных материалах, например, натянутых пластиковых листах, а также о симметрии колебательных мод.
Поляризационно-зависимая рамановская спектроскопия использует (плоско) поляризованное лазерное излучение прошедшее через поляризатор. Собранный рамановский рассеянный свет проходит через второй поляризатор (называемый анализатором) перед входом в детектор. Анализатор ориентирован либо параллельно, либо перпендикулярно поляризации лазера. Спектры, полученные с анализатором, установленным как перпендикулярно, так и параллельно плоскости возбуждения, можно использовать для расчёта коэффициента деполяризации. Обычно между анализатором и детектором также размещают поляризационный скремблер. В поляризованной рамановской спектроскопии удобно описывать направления распространения и поляризации с помощью обозначений Порто[63], описанных и названных в честь бразильского физика Серхио Перейра да Силва Порто.
Для изотропных растворов рамановское рассеяние от каждой моды либо сохраняет поляризацию лазера, либо частично или полностью деполяризует её. Если колебательная мода, участвующая в процессе комбинационного рассеяния, полностью симметрична, то поляризация комбинационного рассеяния будет такой же, как и у падающего лазерного луча. В случае, когда колебательная мода не является полностью симметричной, поляризация будет частично или полностью потеряна (скремблирована), что называется деполяризацией. Следовательно, поляризованная рамановская спектроскопия может предоставить подробную информацию о метках симметрии колебательных мод.
В твёрдом состоянии поляризованная рамановская спектроскопия может оказаться полезна при изучении ориентированных образцов, таких как монокристаллы. Поляризуемость колебательной моды не одинакова вдоль и поперёк связи. Поэтому интенсивность комбинационного рассеяния будет другой, когда поляризация лазера направлена вдоль и ортогонально определённой оси связи. Этот эффект может предоставить информацию об ориентации молекул монокристалла или материала. Спектральная информация, полученная в результате этого анализа, часто используется для понимания ориентации макромолекул в кристаллических решётках, жидких кристаллах или образцах полимеров[64].
Характеристика симметрии колебательной моды
Метод поляризации полезен для понимания связи между молекулярной симметрией, активностью комбинационного рассеяния и пиками в соответствующих спектрах комбинационного рассеяния[65]. Поляризованный свет в одном направлении даёт доступ только к некоторым рамановским активным модам, но вращение поляризации даёт доступ и к другим модам. Каждая мода разделяется в соответствии с её симметрией[66].
Симметрия колебательной моды выводится из коэффициента деполяризации ρ, который представляет собой отношение комбинационного рассеяния с поляризацией, ортогональной падающему лазеру, и комбинационного рассеяния с той же поляризацией, что и падающего излучения лазера: Здесь — интенсивность комбинационного рассеяния, когда анализатор поворачивается на 90 градусов по отношению к оси поляризации падающего света, и интенсивность рамановского рассеяния, когда анализатор совмещён с поляризацией падающего лазера[67]. Когда поляризованный свет взаимодействует с молекулой, он искажает молекулу, что вызывает равный и противоположный эффект в плоской волне, заставляя её вращаться за счёт разницы между ориентацией молекулы и углом поляризации световой волны. Если р ≥ , то вибрации на этой частоте деполяризуются; то есть они не полностью симметричны[68][67].
Типы
Разработано не менее 25 типов рамановской спектроскопии[9]. Обычной целью является повышение чувствительности (например, рамановское рассеяние с усилением поверхности), улучшение пространственного разрешения (рамановская микроскопия) или получение очень специфической информации (резонансное рамановское рассеяние).
Спонтанная (или дальнепольная) рамановская спектроскопия
Такие термины, как спонтанная рамановская спектроскопия или нормальная рамановская спектроскопия, обобщают методы рамановской спектроскопии, основанные на рамановском рассеянии с использованием обычной оптики дальнего поля, как описано выше. Существуют варианты нормальной рамановской спектроскопии в отношении геометрии возбуждения-обнаружения, комбинации с другими методами, использования специальной (поляризационной) оптики и определённого выбора длин волн возбуждения для усиления резонанса.
- Корреляционная рамановская визуализация — рамановскую микроскопию можно комбинировать с дополнительными методами визуализации, такими как атомно-силовая микроскопия (рамановская-АСМ) и сканирующая электронная микроскопия (рамановская-СЭМ), для сравнения карт рамановского распределения с топографическими или морфологическими изображениями (или наложения их на них) и коррелировать спектры комбинационного рассеяния с дополнительной физической или химической информацией (например, полученной с помощью SEM-EDX).
- Резонансная рамановская спектроскопия. Длина волны возбуждения соответствует электронному переходу молекулы или кристалла, так что колебательные моды, связанные с возбужденным электронным состоянием, значительно усиливаются. Это полезно для изучения больших молекул, таких как полипептиды, которые могут показывать сотни полос в «обычных» рамановских спектрах. Это также полезно для нахождения соответствия нормальных мод и их наблюдаемых частотных сдвигов[70].
- Спектроскопия комбинационного рассеяния света с угловым разрешением. Записываются не только стандартные результаты комбинационного рассеяния, но и угол по отношению к падающему лазеру. Если ориентация образца известна, то подробную информацию о законе дисперсии фононов также можно получить из одного измерения[71].
- Спектроскопия комбинационного рассеяния света с оптическим пинцетом (OTRS) — используется для изучения отдельных частиц и даже биохимических процессов в отдельных клетках, захваченных оптическим пинцетом[72][73][74].
- Рамановская спектроскопия с пространственным смещением (SORS) — комбинационное рассеяние под затеняющей поверхностью извлекается из масштабированного вычитания двух спектров, снятых в двух пространственно смещенных точках.
- Рамановская оптическая активность (ROA) — измеряет колебательную оптическую активность посредством небольшой разницы в интенсивности комбинационного рассеяния от хиральных молекул в падающем свете с правой и левой круговой поляризацией или, что то же самое, небольшой компонент с круговой поляризацией в рассеянном свете[75].
- Рамановский спектр на просвет — позволяет исследовать значительный объём мутного материала, такого как порошки, капсулы, живые ткани и т. д. После исследований, проведённых в конце 1960-х годов (Schrader and Bergmann, 1967)[76], его в значительной степени игнорировали, но в 2006 году он был вновь открыт как средство экспресс-анализа лекарственных форм[77]. Существуют медицинские диагностические приложения, особенно в обнаружении рака[35][78][79].
- Субстраты с микрополостями — метод, улучшающий предел обнаружения обычных спектров комбинационного рассеяния с использованием микро-рамановского рассеяния в микрополости, покрытой отражающим золотом или серебром. Микрорезонатор имеет радиус в несколько микрометров и усиливает весь рамановский сигнал за счёт многократного возбуждения образца и направляет рамановские фотоны, рассеянные вперед, к собирающей оптике в геометрии обратного рамановского рассеяния[80].
- Дистанционный рамановский анализатор. — При дистанционном рамановском анализе образец измеряется на расстоянии от рамановского спектрометра, обычно с помощью телескопа для сбора света. Дистанционная рамановская спектроскопия была предложена в 1960-х годах[81] и первоначально была разработана для измерения атмосферных газов[82]. Метод был расширен в 1992 году Ангелом и соавт. для обнаружения опасных неорганических и органических соединений удалённо[83].
- Рентгеновское комбинационное рассеяние — измеряет электронные переходы, а не вибрации[84].
Усиленная (или ближняя) рамановская спектроскопия
Усиление рамановского рассеяния достигается локальным усилением электрического поля за счёт оптических эффектов ближнего поля (например, локализованных поверхностных плазмонов).
- Рамановская спектроскопия с усилением поверхности (SERS) — обычно проводится в коллоиде серебра или золота или на подложке, содержащей серебро или золото. Поверхностные плазмоны серебра и золота возбуждаются лазером, что приводит к увеличению электрических полей, окружающих металл. Учитывая, что интенсивность комбинационного рассеяния пропорциональна электрическому полю, наблюдается значительное увеличение измеренного сигнала (до 1011). Этот эффект первоначально наблюдал Мартин Флейшманн, но преобладающее объяснение было предложено Ван Дуйном в 1977 году[85]. Всеобъемлющая теория эффекта была дана Ломбарди и Бирке[86].
- Резонансная спектроскопия комбинационного рассеяния с усилением поверхности (SERRS) — комбинация SERS и резонансной спектроскопии комбинационного рассеяния, в которой используется близость к поверхности для увеличения интенсивности комбинационного рассеяния, а длина волны возбуждения соответствует максимальному поглощению анализируемой молекулы.
- Спектроскопия комбинационного рассеяния с усилением наконечника (TERS) — использует металлический наконечник (обычно АСМ или СТМ зонд с серебряным/золотым покрытием) для усиления сигналов комбинационного рассеяния молекул, расположенных поблизости. Пространственное разрешение примерно равно размеру вершины иглы (20-30 нм). Было показано, что TERS обладает чувствительностью вплоть до уровня одной молекулы[87][88][89][90] и имеет некоторые перспективы для приложений биоанализа[91] и секвенирования ДНК[62]. TERS использовался для отображения нормальных мод колебаний одиночных молекул[92].
- Комбинационное рассеяние, усиленное поверхностным плазмон-поляритоном (SPPERS). В этом подходе используются металлические конические наконечники без отверстий для возбуждения молекул в ближнем поле. Этот метод отличается от подхода TERS из-за присущей ему способности подавлять фоновое поле. В самом деле, когда соответствующий лазерный источник падает на основание конуса, TM0-мода[93] (поляритонная мода) может создаваться локально, а именно вдали от пятна возбуждения (вершины острия). Мода может распространяться вдоль острия, не создавая поля излучения вплоть до вершины острия, где она взаимодействует с молекулой. Таким образом, фокальная плоскость отделена от плоскости возбуждения на расстояние, определяемое длиной зонда, и фон не играет никакой роли в рамановском возбуждении молекулы[94][95][96][97].
Нелинейная рамановская спектроскопия
Усиление рамановского сигнала достигается за счёт нелинейных оптических эффектов, обычно реализуемых путём смешивания двух или более длин волн, излучаемых пространственно и временно синхронизированными импульсными лазерами.
- Гиперрамановский эффект — нелинейный эффект, при котором колебательные моды взаимодействуют со второй гармоникой возбуждающего луча. Это требует очень большой мощности, но позволяет наблюдать колебательные моды, которые обычно «тихие». Он часто использует усиление типа SERS для повышения чувствительности[98].
- Стимулированная рамановская спектроскопия (SRS) — метод накачки-зонда, при котором пространственно совпадающий двухцветный импульс (с параллельной или перпендикулярной поляризацией) переводит молекулу из основного состояния в колебательно-возбуждённое. Если разница в энергии соответствует разрешённому рамановскому переходу, рассеянный свет будет соответствовать потерям или усилениям в пучке накачки.
- Обратная спектроскопия комбинационного рассеяния — синоним спектроскопии вынужденных комбинационных потерь.
- Когерентная антистоксова спектроскопия комбинационного рассеяния (CARS) — два лазерных луча используются для генерации когерентного луча антистоксовой частоты, который можно усилить резонансом.
Морфологически направленная рамановская спектроскопия
Морфологически направленная рамановская спектроскопия (MDRS) объединяет автоматизированную визуализацию частиц и рамановскую микроспектроскопию в единую интегрированную платформу для определения размера, формы и химической идентификации частиц[99][100]. Автоматизированная визуализация частиц определяет распределение частиц по размеру и форме компонентов в смешанном образце по изображениям отдельных частиц[101][100]. Информация, полученная в результате автоматизированной визуализации частиц, затем используется для управления спектроскопическим анализом комбинационного рассеяния[99]. Процесс анализа рамановской спектроскопии выполняется на случайно выбранном подмножестве частиц, что позволяет химическую идентификацию нескольких компонентов образца[99]. Десятки тысяч частиц можно отобразить за считанные минуты с помощью метода MDRS, что делает этот процесс идеальным для судебно-медицинской экспертизы и расследования поддельных фармацевтических препаратов и последующего судебного разбирательства[101][100].
Примечания
- Gardiner, D.J. Practical Raman spectroscopy. — Springer-Verlag, 1989. — ISBN 978-0-387-50254-0.
- Hammes, Gordon G. Spectroscopy for the biological sciences. — Wiley, 2005. — ISBN 9780471733546.
- Confocal Raman Microscopy (англ.) / Jan Toporski, Thomas Dieing, Olaf Hollricher (Eds.). — Second Edition. — Springer, 2018. — P. 20. — ISBN 978-3-319-75378-2.
- Smekal, A. (1923). “Zur Quantentheorie der Dispersion”. Die Naturwissenschaften. 11 (43): 873—875. Bibcode:1923NW.....11..873S. DOI:10.1007/BF01576902.
- Caltech oral history interview by Judith R. Goodstein, 4 February 1982
- Placzek, G. Rayleigh-Streuung und Raman-Effekt // Handbuch der Radiologie : [нем.]. — Leipzig : Akademische Verlagsgesellschaft, 1934. — Vol. 6,2. — P. 209.
- K. S. Krishnan (1928). “The Negative Absorption of Radiation”. Nature. 122 (3062): 12—13. Bibcode:1928Natur.122...12R. DOI:10.1038/122012b0. ISSN 1476-4687.
- Thomas Schmid (2019). “Raman Microspectroscopic Imaging of Binder Remnants in Historical Mortars Reveals Processing Conditions”. Heritage. 2 (2): 1662—1683. DOI:10.3390/heritage2020102. ISSN 2571-9408.
- Long, Derek A. The Raman Effect. — John Wiley & Sons, Ltd, 2002. — ISBN 978-0471490289. — doi:10.1002/0470845767.
- McCreery, Richard L. Raman spectroscopy for chemical analysis. — New York : John Wiley & Sons, 2000. — ISBN 0471231878.
- Kukura, Philipp (2007). “Femtosecond Stimulated Raman Spectroscopy”. Annual Review of Physical Chemistry. 58 (1): 461—488. Bibcode:2007ARPC...58..461K. DOI:10.1146/annurev.physchem.58.032806.104456. ISSN 0066-426X. PMID 17105414.
- Elliott, Anastasia B. S. (2012). “Vibrational spectroscopy as a probe of molecule-based devices”. Chem. Soc. Rev. 41 (5): 1929—1946. DOI:10.1039/C1CS15208D. ISSN 0306-0012. PMID 22008975.
- Efremov, Evtim V. (2007). “Fluorescence Rejection in Resonance Raman Spectroscopy Using a Picosecond-Gated Intensified Charge-Coupled Device Camera”. Applied Spectroscopy. 61 (6): 571—578. Bibcode:2007ApSpe..61..571E. DOI:10.1366/000370207781269873. ISSN 0003-7028. PMID 17650366.
- Grating Dispersion/Resolution Calculator. princetoninstruments.com. Дата обращения: 22 июля 2019.
- Gordon. Investigating Crystallinity Using Low Frequency Raman Spectroscopy: Applications in Pharmaceutical Analysis. spectroscopyonline.com. Дата обращения: 21 июля 2019.
- BragGrate- Bandpass ASE Suppression Filters. optigrate.com. Дата обращения: 21 июля 2019.
- SureBlock- Ultra Narrow-band Notch Filters. coherent.com. Дата обращения: 25 марта 2021.
- THE FINGERPRINT REGION OF AN INFRA-RED SPECTRUM Chemguide, Jim Clark 2000
- Khanna, R.K. (1981). “Raman-spectroscopy of oligomeric SiO species isolated in solid methane”. Journal of Chemical Physics. 74 (4). Bibcode:1981JChPh..74.2108K. DOI:10.1063/1.441393.
- FDA approves Gilead cystic fibrosis drug Cayston, BusinessWeek (February 23, 2010). Дата обращения 5 марта 2010.
- Chou, Kuo-Chen (1977). “The biological functions of low-frequency phonons”. Scientia Sinica. 20 (3): 447—457.
- Urabe, H. (1983). “Experimental evidence of collective vibrations in DNA double helix Raman spectroscopy”. Journal of Chemical Physics. 78 (10): 5937—5939. Bibcode:1983JChPh..78.5937U. DOI:10.1063/1.444600.
- Chou, K.C. (1983). “Identification of low-frequency modes in protein molecules”. Biochemical Journal. 215 (3): 465—469. DOI:10.1042/bj2150465. PMID 6362659.
- Chou, K.C. (1984). “Low-frequency vibration of DNA molecules”. Biochemical Journal. 221 (1): 27—31. DOI:10.1042/bj2210027. PMID 6466317.
- Urabe, H. (1998). “Low-frequency Raman spectra of lysozyme crystals and oriented DNA films: dynamics of crystal water”. Biophys J. 74 (3): 1533—1540. Bibcode:1998BpJ....74.1533U. DOI:10.1016/s0006-3495(98)77865-8. PMID 9512049.
- Chou, Kuo-Chen (1988). “Review: Low-frequency collective motion in biomacromolecules and its biological functions”. Biophysical Chemistry. 30 (1): 3—48. DOI:10.1016/0301-4622(88)85002-6. PMID 3046672.
- Chou, K.C. (1989). “Low-frequency resonance and cooperativity of hemoglobin”. Trends in Biochemical Sciences. 14 (6): 212—3. DOI:10.1016/0968-0004(89)90026-1. PMID 2763333.
- Schlücker, S. (2011). “Design and synthesis of Raman reporter molecules for tissue imaging by immuno-SERS microscopy”. Journal of Biophotonics. 4 (6): 453—463. DOI:10.1002/jbio.201000116. PMID 21298811.
- Jain, R. (2014). “Raman Spectroscopy Enables Noninvasive Biochemical Characterization and Identification of the Stage of Healing of a Wound”. Analytical Chemistry. 86 (8): 3764—3772. DOI:10.1021/ac500513t. PMID 24559115.
- Fake drugs caught inside the pack, BBC News (31 января 2007). Дата обращения 8 декабря 2008.
- Butler, Holly J. (2016). “Using Raman spectroscopy to characterize biological materials”. Nature Protocols. 11 (4): 664—687. DOI:10.1038/nprot.2016.036. PMID 26963630. Дата обращения 2017-05-22.
- Taylor, P.D. (2010). “Raman spectroscopic study of the mineral composition of cirratulid tubes (Annelida, Polychaeta)”. Journal of Structural Biology. 171 (3): 402—405. DOI:10.1016/j.jsb.2010.05.010. PMID 20566380. Дата обращения 2014-06-10.
- Ben Vogel. Raman spectroscopy portends well for standoff explosives detection. Jane's (29 August 2008). Дата обращения: 29 августа 2008. Архивировано 3 декабря 2008 года.
- «Finding explosives with laser beams», a TU Vienna press-release
- Misra, Anupam K. (2012). “Single-Pulse Standoff Raman Detection of Chemicals from 120 m Distance During Daytime”. Applied Spectroscopy. 66 (11): 1279—85. Bibcode:2012ApSpe..66.1279M. DOI:10.1366/12-06617. PMID 23146183.
- Working Groups | raman4clinics.eu. raman4clinics.eu. Дата обращения: 22 мая 2017.
- Howell G. M. Edwards, John M. Chalmers, Raman Spectroscopy in Archaeology and Art History, Royal Society of Chemistry, 2005
- McCann, Lowell I. (1999). “Corrosion of ancient Chinese bronze money trees studied by Raman microscopy”. Journal of Raman Spectroscopy [англ.]. 30 (2): 121—132. Bibcode:1999JRSp...30..121M. DOI:10.1002/(SICI)1097-4555(199902)30:2<121::AID-JRS355>3.0.CO;2-L. ISSN 1097-4555.
- Trentelman, Karen (2009). “Investigation of the painting materials and techniques of the late-15th century manuscript illuminator Jean Bourdichon”. Journal of Raman Spectroscopy [англ.]. 40 (5): 577—584. Bibcode:2009JRSp...40..577T. DOI:10.1002/jrs.2186. ISSN 1097-4555.
- Raman Spectroscopy at ColourLex
- Dariz, Petra (2021). “Trace compounds in Early Medieval Egyptian blue carry information on provenance, manufacture, application, and ageing”. Scientific Reports. 11. DOI:10.1038/s41598-021-90759-6.
- Quinn, Eamon (May 28, 2007) Irish classic is still a hit (in calfskin, not paperback). New York Times
- Candeias, Antonio (2019). “Applications of Raman spectroscopy in art and archaeology”. Journal of Raman Spectroscopy [англ.]. 50 (2): 137—142. DOI:10.1002/jrs.5571. ISSN 1097-4555.
- Home | IRUG. www.irug.org. Дата обращения: 15 мая 2020.
- Lothar Opilik (2013). “Modern Raman Imaging: Vibrational Spectroscopy on the Micrometer and Nanometer Scales”. Annual Review of Analytical Chemistry. 6: 379—398. Bibcode:2013ARAC....6..379O. DOI:10.1146/annurev-anchem-062012-092646. ISSN 1936-1335. PMID 23772660.
- Marcet, S. (2012). “Raman Spectroscopy hyperspectral imager based on Bragg Tunable Filters”. SPIE Photonics North. 8412: 84121J. Bibcode:2012SPIE.8412E..1JM. DOI:10.1117/12.2000479.
- Sebastian Schlücker (2003). “Raman Microspectroscopy: A Comparison of Point, Line, and Wide-Field Imaging Methodologies”. Analytical Chemistry. 75 (16): 4312—4318. DOI:10.1021/ac034169h. ISSN 1520-6882. PMID 14632151.
- Robin W. Havener (December 2011). “High-Throughput Graphene Imaging on Arbitrary Substrates with Widefield Raman Spectroscopy”. ACS Nano. 6 (1): 373—80. DOI:10.1021/nn2037169. PMID 22206260.
- Gaufrès, E. (2014). “Giant Raman scattering from J-aggregated dyes inside carbon nanotubes for multispectral imaging”. Nature Photonics. 8 (1): 72—78. Bibcode:2014NaPho...8...72G. DOI:10.1038/nphoton.2013.309.
- Confocal Raman Microscopy. — Springer, 2018. — Vol. 66. — ISBN 978-3-319-75378-2. — doi:10.1007/978-3-319-75380-5.
- Neil J. Everall (2009). “Confocal Raman Microscopy: Performance, Pitfalls, and Best Practice”. Applied Spectroscopy. 63 (9): 245A—262A. Bibcode:2009ApSpe..63..245E. DOI:10.1366/000370209789379196. ISSN 1943-3530. PMID 19796478.
- Supporting Information of T. Schmid (2015). “Orientation-distribution mapping of polycrystalline materials by Raman microspectroscopy”. Scientific Reports. 5: 18410. Bibcode:2015NatSR...518410S. DOI:10.1038/srep18410. ISSN 2045-2322. PMID 26673970.
- Ellis DI (August 2006). “Metabolic fingerprinting in disease diagnosis: biomedical applications of infrared and Raman spectroscopy”. Analyst. 131 (8): 875—85. Bibcode:2006Ana...131..875E. DOI:10.1039/b602376m. PMID 17028718.
- David Tuschel (2016). “Selecting an Excitation Wavelength for Raman Spectroscopy”. Spectroscopy Online. 31 (3): 14—23.
- K. Christian Schuster (2000). “Multidimensional Information on the Chemical Composition of Single Bacterial Cells by Confocal Raman Microspectroscopy”. Analytical Chemistry. 72 (22): 5529—5534. DOI:10.1021/ac000718x. ISSN 1520-6882. PMID 11101227.
- Shan Yang (2017). “1064-nm Raman: The Right Choice for Biological Samples?”. Spectroscopy Online. 32 (6): 46—54.
- Zanyar Movasaghi (2007). “Raman Spectroscopy of Biological Tissues”. Applied Spectroscopy Reviews. 42 (5): 493—541. Bibcode:2007ApSRv..42..493M. DOI:10.1080/05704920701551530. ISSN 1520-569X.
- Peter J.Caspers (2001). “In Vivo Confocal Raman Microspectroscopy of the Skin: Noninvasive Determination of Molecular Concentration Profiles”. Journal of Investigative Dermatology. 116 (3): 434—442. DOI:10.1046/j.1523-1747.2001.01258.x. ISSN 0022-202X. PMID 11231318.
- Pawel L. Urban (2011). “Multidimensional Analysis of Single Algal Cells by Integrating Microspectroscopy with Mass Spectrometry”. Analytical Chemistry. 83 (5): 1843—1849. DOI:10.1021/ac102702m. ISSN 1520-6882. PMID 21299196.
- Apkarian, V. Ara (April 2019). “Visualizing vibrational normal modes of a single molecule with atomically confined light”. Nature. 568 (7750): 78—82. Bibcode:2019Natur.568...78L. DOI:10.1038/s41586-019-1059-9. ISSN 1476-4687. PMID 30944493.
- Crampton, Kevin T. (2019-06-25). “Ion-Selective, Atom-Resolved Imaging of a 2D Cu2N Insulator: Field and Current Driven Tip-Enhanced Raman Spectromicroscopy Using a Molecule-Terminated Tip”. ACS Nano. 13 (6): 6363—6371. DOI:10.1021/acsnano.9b02744. ISSN 1936-0851. PMID 31046235.
- He, Zhe (2019-01-16). “Tip-Enhanced Raman Imaging of Single-Stranded DNA with Single Base Resolution”. Journal of the American Chemical Society. 141 (2): 753—757. DOI:10.1021/jacs.8b11506. ISSN 0002-7863. PMID 30586988.
- Raman scattering. cryst.ehu.es. Дата обращения: 4 июля 2019.
- Khanna, R.K. (1957). “Evidence of ion-pairing in the polarized Raman spectra of a Ba2+—CrO42- doped KI single crystal”. Journal of Raman Spectroscopy. 4 (1): 25—30. Bibcode:1975JRSp....4...25G. DOI:10.1002/jrs.1250040104.
- Itoh, Yuki (May 2, 2012). “Polarization Dependence of Raman Scattering from a Thin Film Involving Optical Anisotropy Theorized for Molecular Orientation Analysis”. The Journal of Physical Chemistry A. 116 (23): 5560—5570. Bibcode:2012JPCA..116.5560I. DOI:10.1021/jp301070a. PMID 22551093.
- Iliev, M. N. (February 16, 2006). “Distortion-dependent Raman spectra and mode mixing in RMnO3 perovskites (R=La,Pr,Nd,Sm,Eu,Gd,Tb,Dy,Ho,Y)”. Physical Review B. 73 (6): 064302. Bibcode:2006PhRvB..73f4302I. DOI:10.1103/physrevb.73.064302.
- Fundamentals of Molecular Spectroscopy. — ISBN 978-0-07-707976-5.
- What is polarised Raman spectroscopy? - HORIBA. horiba.com.
- Li, Xufan (2014). “Controlled Vapor Phase Growth of Single Crystalline, Two-Dimensional Ga Se Crystals with High Photoresponse”. Scientific Reports. 4: 5497. Bibcode:2014NatSR...4E5497L. DOI:10.1038/srep05497. PMID 24975226.
- Chao RS (1974). “Theoretical and experimental resonance Raman intensities for the manganate ion”. Journal of Raman Spectroscopy. 3 (2—3): 121—131. Bibcode:1975JRSp....3..121C. DOI:10.1002/jrs.1250030203.
- Zachary J. Smith (2008). “Integrated Raman- and angular-scattering microscopy” (PDF). Opt. Lett. 3 (7): 714—716. Bibcode:2008OptL...33..714S. DOI:10.1364/OL.33.000714. PMID 18382527.
- Li, Yong-qing (2017-02-17). “Stable optical trapping and sensitive characterization of nanostructures using standing-wave Raman tweezers”. Scientific Reports. 7: 42930. Bibcode:2017NatSR...742930W. DOI:10.1038/srep42930. ISSN 2045-2322. PMID 28211526.
- Esat, Kivanç (2018). “Phase transition dynamics of single optically trapped aqueous potassium carbonate particles”. Phys. Chem. Chem. Phys. 20 (17): 11598—11607. Bibcode:2018PCCP...2011598E. DOI:10.1039/c8cp00599k. PMID 29651474.
- Zhiyong, Gong (2018). “Optical trapping-Raman spectroscopy (OT-RS) with embedded microscopy imaging for concurrent characterization and monitoring of physical and chemical properties of single particles”. Anal. Chim. Acta. 1020: 86—94. DOI:10.1016/j.aca.2018.02.062. PMID 29655431.
- Barron LD (2004). “Raman optical activity comes of age”. Mol. Phys. 102 (8): 731—744. Bibcode:2004MolPh.102..731B. DOI:10.1080/00268970410001704399.
- Schrader, Bernhard (1967). “Die Intensität des Ramanspektrums polykristalliner Substanzen”. Fresenius' Zeitschrift für Analytische Chemie. 225 (2): 230—247. DOI:10.1007/BF00983673. ISSN 0016-1152.
- Matousek, P. (2006). “Bulk Raman Analysis of Pharmaceutical Tablets”. Applied Spectroscopy. 60 (12): 1353—1357. Bibcode:2006ApSpe..60.1353M. DOI:10.1366/000370206779321463. PMID 17217583.
- Matousek, P. (2007). “Prospects for the diagnosis of breast cancer by noninvasive probing of calcifications using transmission Raman spectroscopy”. Journal of Biomedical Optics. 12 (2). Bibcode:2007JBO....12b4008M. DOI:10.1117/1.2718934. PMID 17477723.
- Kamemoto, Lori E. (December 4, 2009). “Near-Infrared Micro-Raman Spectroscopy for in Vitro Detection of Cervical Cancer”. Applied Spectroscopy. 64 (3): 255—61. Bibcode:2010ApSpe..64..255K. DOI:10.1366/000370210790918364. PMID 20223058.
- Misra, Anupam K. (December 8, 2008). “Novel Micro-Cavity Substrates for Improving the Raman Signal from Submicrometer Size Materials”. Applied Spectroscopy. 63 (3): 373—7. Bibcode:2009ApSpe..63..373M. DOI:10.1366/000370209787598988. PMID 19281655.
- Cooney, J. (1965). “International symposium on electromagnetic sensing of the earth from satellites”. Bulletin of the American Meteorological Society. 46 (10): 683—684. Bibcode:1965BAMS...46..683.. DOI:10.1175/1520-0477-46.10.683.
- Leonard, Donald A. (1967). “Observation of Raman Scattering from the Atmosphere using a Pulsed Nitrogen Ultraviolet Laser”. Nature. 216 (5111): 142—143. Bibcode:1967Natur.216..142L. DOI:10.1038/216142a0.
- Vess, Thomas M. (1992-07-01). “Remote-Raman Spectroscopy at Intermediate Ranges Using Low-Power cw Lasers”. Applied Spectroscopy. 46 (7): 1085—1091. Bibcode:1992ApSpe..46.1085A. DOI:10.1366/0003702924124132.
- Schülke. Electron dynamics studied by inelastic x-ray scattering.
- Jeanmaire DL (1977). “Surface Raman Electrochemistry Part I. Heterocyclic, Aromatic and Aliphatic Amines Adsorbed on the Anodized Silver Electrode”. Journal of Electroanalytical Chemistry. 84: 1—20. DOI:10.1016/S0022-0728(77)80224-6.
- Lombardi JR (2008). “A Unified Approach to Surface-Enhanced Raman Spectroscopy”. Journal of Physical Chemistry C. 112 (14): 5605—5617. DOI:10.1021/jp800167v.
- Hou, J. G. (June 2013). “Chemical mapping of a single molecule by plasmon-enhanced Raman scattering”. Nature. 498 (7452): 82—86. Bibcode:2013Natur.498...82Z. DOI:10.1038/nature12151. ISSN 1476-4687. PMID 23739426.
- Lee, Joonhee (2017-10-12). “Tip-Enhanced Raman Spectromicroscopy of Co(II)-Tetraphenylporphyrin on Au(111): Toward the Chemists' Microscope”. ACS Nano. 11 (11): 11466—11474. DOI:10.1021/acsnano.7b06183. ISSN 1936-0851. PMID 28976729.
- Tallarida, Nicholas (2017-10-09). “Tip-Enhanced Raman Spectromicroscopy on the Angstrom Scale: Bare and CO-Terminated Ag Tips”. ACS Nano. 11 (11): 11393—11401. DOI:10.1021/acsnano.7b06022. ISSN 1936-0851. PMID 28980800.
- Lee, Joonhee (June 2018). “Microscopy with a single-molecule scanning electrometer”. Science Advances. 4 (6): eaat5472. Bibcode:2018SciA....4.5472L. DOI:10.1126/sciadv.aat5472. ISSN 2375-2548. PMID 29963637.
- Hermann, P (2011). “Evaluation of tip-enhanced Raman spectroscopy for characterizing different virus strains”. Analyst. 136 (2): 1148—1152. Bibcode:2011Ana...136.1148H. DOI:10.1039/C0AN00531B. PMID 21270980.
- Lee, Joonhee (April 2019). “Visualizing vibrational normal modes of a single molecule with atomically confined light”. Nature. 568 (7750): 78—82. Bibcode:2019Natur.568...78L. DOI:10.1038/s41586-019-1059-9. ISSN 0028-0836. PMID 30944493.
- Novotny, L (1994). “Light propagation in a cylindrical waveguide with a complex, metallic, dielectric function”. Physical Review E. 50 (5): 4094—4106. Bibcode:1994PhRvE..50.4094N. DOI:10.1103/PhysRevE.50.4094. PMID 9962466.
- De Angelis, F (2010). “Nanoscale chemical mapping using three-dimensional adiabatic compression of surface plasmon polaritons”. Nature Nanotechnology. 5 (1): 67—72. Bibcode:2010NatNa...5...67D. DOI:10.1038/nnano.2009.348. PMID 19935647.
- De Angelis, F (2011). “Multi-scheme approach for efficient surface plasmon polariton generation in metallic conical tips on AFM-based cantilevers”. Optics Express. 19 (22): 22268—79. Bibcode:2011OExpr..1922268D. DOI:10.1364/OE.19.022268. PMID 22109069.
- Proietti Zaccaria, R (2012). “Fully analytical description of adiabatic compression in dissipative polaritonic structures”. Physical Review B. 86 (3). Bibcode:2012PhRvB..86c5410P. DOI:10.1103/PhysRevB.86.035410.
- Proietti Zaccaria, R (2012). “Surface plasmon polariton compression through radially and linearly polarized source”. Optics Letters. 37 (4): 545—7. Bibcode:2012OptL...37..545Z. DOI:10.1364/OL.37.000545. PMID 22344101.
- Kneipp K (1999). “Surface-Enhanced Non-Linear Raman Scattering at the Single Molecule Level”. Chem. Phys. 247 (1): 155—162. Bibcode:1999CP....247..155K. DOI:10.1016/S0301-0104(99)00165-2.
- Malvern Panalytical. MDRS Morphologically Directed Raman Spectroscopy.
- Morphologically Directed Raman Spectroscopic Analysis of Forensic Samples, Spectroscopy Onlinet (January 2018).
- “Introducing morphologically directed Raman spectroscopy: A powerful tool for the detection of counterfeit drugs”. Quality Control. Manufacturing Chemist. October 2016.
Литература
- Vandenabeele, Peter. Practical Raman spectroscopy: An Introduction. — Wiley, 2013. — ISBN 978-0470683194.
Ссылки
- Учебно-обучающий пакет DoITPoMS — Рамановская спектроскопия — введение в рамановскую спектроскопию, предназначенное для студентов бакалавриата.
- Рамановская спектроскопия в анализе картин, ColourLex
- База данных группы пользователей инфракрасного и рамановского спектров, IRUG

_(2019)_1662-1683_landscape.png.webp)
