Молекулярные колебания
Молекуля́рные колеба́ния — один из трёх типов молекулярного движения, к которым относятся также трансляционное движение (когда все атомы молекулы смещаются в одном направлении) и вращательное движение (когда молекула поворачивается на определённый угол). В отличие от последних двух случаев, когда геометрия молекулы не меняется, при колебаниях происходит изменение положения атомов относительно друг друга.
В общем случае, молекула из N атомов обладает 3N − 6 нормальными колебаниями, за исключением линейных молекул, у которых 3N − 5 колебаний. Двухатомная молекула, как частный случай линейной, обладает всего одним колебанием, при котором меняется расстояние между двумя атомами молекулы.
Типы колебаний
В случае многоатомных молекул колебания довольно сложны, и их обычно описывают как комбинацию колебаний разных фрагментов молекулы. Часто это трёхатомные фрагменты молекулы, например, метиленовая группа (−CH2−) в органических молекулах. Можно выделить шесть типов колебаний трёхатомного фрагмента молекулы: симметричное и антисимметричное валентные колебания, ножничное, маятниковое, веерное и крутильное. Для молекул, содержащих только три атома, например, молекулы воды, последние три типа колебаний не существуют, так как они соответствуют просто вращениям молекулы относительно трёх взаимноперпендикулярных осей (для этих колебаний расстояния между тремя атомами фрагмента не меняются).
| Валентные колебания (Stretching) | Ножничное (Scissoring) | |
|---|---|---|
| Симметричное | Антисимметричное | |
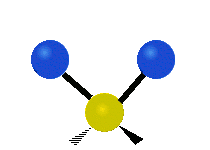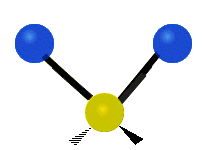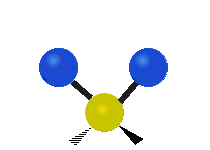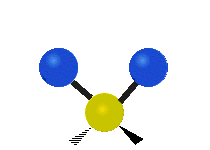 |
 |
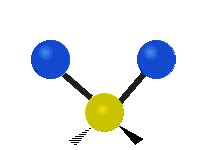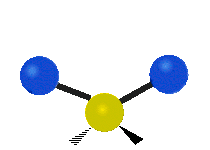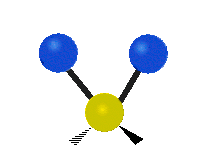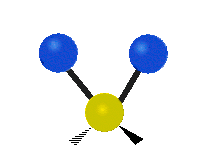 |
| Маятниковое (Rocking) | Веерное (Wagging) | Крутильное (Twisting) |
|---|---|---|
 |
 |
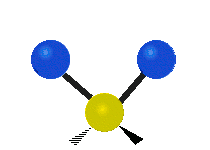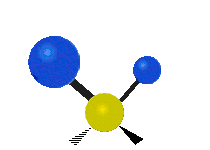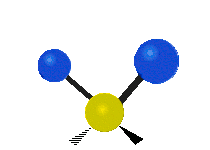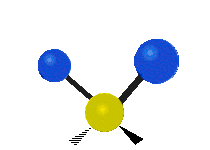 |
Энергия колебаний
Классическая механика

В классической механике колебания молекулы рассматриваются с позиции, что связи между атомами ведут себя как пружины. В гармоническом приближении колебания подчиняются закону Гука: сила которую требуется приложить для растяжения пружины, прямо пропорциональна величине растяжения . Константа пропорциональности в случае молекулярных колебаний называется силовой константой
Из второго закона Ньютона эта сила равняется также произведению приведённой массы и ускорения:
Из этого получаем обыкновенное дифференциальное уравнение:
Его решением являются гармонические колебания:
где — амплитуда координаты колебания Для двухатомной молекулы AB приведённая масса равняется:
- где mA и mB — массы атомов A и B.
В гармоническом приближении потенциальная энергия молекулы является квадратичной функцией от нормальной координаты. В этом случае силовая константа равна второй производной потенциальной энергии:
Квантовая механика
В квантовой механике, так же, как и в классической, потенциальная энергия гармонического осциллятора является квадратичной функцией от нормальной координаты. Из решения уравнения Шрёдингера возможны следующие значения энергии колебаний:
где n — квантовое число, которое принимает значения 0, 1, 2… В молекулярной спектроскопии это колебательное квантовое число часто обозначается как v[1][2], так как возможны и другие типы энергии молекулы, которым соответствуют другие квантовые числа.
Примечания
- J.M. Hollas, Modern Spectroscopy (3rd ed., John Wiley 1996), p21
- P.W. Atkins and J. de Paula, Physical Chemistry (8th ed., W.H. Freeman 2006), p. 291 and p. 453