Миколовые кислоты
Микóловые кислóты (от лат. Myco — гриб) — обобщённое название группы длинноцепочечных разветвлённых жирных кислот, имеющие общую формулу R1-CHOH-CHR2-COOH[1], с перекрестными сшивками, содержащие по 60-90 атомов углерода в молекуле (С60-С90). Являются исключительным компонентом клеточной стенки микобактерий, включая патогенную Mycobacterium tuberculosis. Выполняют защитную функцию, благодаря низкой реакционной способности этих кислот, которые делают поверхность микобактерий воскообразной и сильно гидрофобной[1], а также очень устойчивой к негативному внешнему воздействию. Это способствует их выживанию в экстремальных условиях (кипячение, растворение в серной кислоте итд.). Миколовые кислоты M.tuberculosis являются самыми длинными и имеют наибольшие боковые цепи (С20-С24)[2]. Большинство миколовых кислот также содержат различные функциональные группы. Впервые были выделены в 1938 году Андерсоном, Стодолой и Лесюком на кафедре химии Йельского университета из экстракта M.tuberculosis[3].
Строение на примере M. tuberculosis
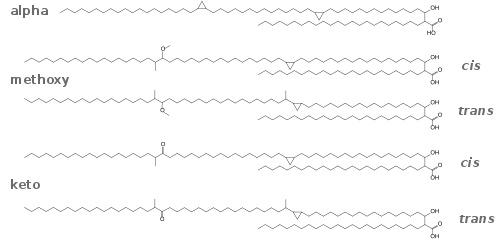
M. tuberculosis синтезирует три основных типа миколовых кислот: альфа-, метокси- и кетомиколовые кислоты. Они представляют собой β-гидроксижирные гидрофобные кислоты с длинной α-алкилированной боковой цепью, из которых α-миколовая кислота является самой распространённой формой (>70 %) и представляет собой цис-дициклопропил жирную кислоту. Метокси-миколовые кислоты, содержат несколько метоксигрупп, и составляют около 10-15 % от общего количества миколовых кислот. Кето-миколовые кислоты, в молекулах которых содержатся несколько кетоновых групп, составляют 10-15 % от общего количества миколовых кислот.
Циклопропановое кольцо, входящее в состав миколовых кислот способствует структурной целостности и защищает клеточную стенку микобактерии от окислительного стресса[4].
Во внутреннем слое внешней мембраны микобактерий миколовые кислоты ковалентно связаны с полисахаридом арабиногалактаном, образущие с ним комплекс арбиногалактан-миколат. Посредством арабиногалактана, связываются с муреином. Внешний слой образован гликолипидной оболочкой, в которой миколовые кислоты не связаны ковалентно с полисахаридом[4].
Биосинтез
Наличие миколовых кислот у M. tuberculosis делает её устойчивой ко многим видам медикаментозного лечения, и их синтез абсолютно необходим для выживания этого патогена. Именно по этой причине синтез миколовых кислот был наиболее детально изучен у этого организма[4][5]. Процесс включает пять стадий, идущих в следующем порядке[6]:
- Синтез C26 насыщенной жирной кислоты ферментом синтаза жирных кислот I типа, которая становится α-алкиловой ветвью миколовой кислоты;
- Синтез C56 жирной кислоты синтазой жирных кислот II типа из которой получается меромиколовая основа;
- Введение в меромиколовую цепь функциональных групп при помощи множества циклопропансинтаз;
- Реакция конденсации α-ветви и меромиколовой цепи ферментом поликетидсинтаза Pks13, после чего происходит финальная реакция синтеза миколовых кислот — восстановление ферментом коринебактериальной миколатредуктазой A (CmrA)[7];
- Соединение остатка миколовой кислоты с арабиногалактаном или другим сахаром, например трегалозой, при помощи комплекса антигена 85 (Ag85);
Синтезы жирных кислот I и II типа тесно связаны между собой, так как первая поставляет субстраты для второй. Синтезированная синтазой I пальмитиновая кислота (С16) переносится на растворимый ацил-переносящий белок при помощи фермента бета-кетоацил-АПБ-синтазы III, после чего поступает к синтазе жирных кислот II типа, где удлиняется до C56 с образованием меромиколовой кислоты. Ингибиторы этого фермента сейчас рассматриваются как потенциальные лекарства для борьбы с туберкулёзом.
Функции
Миколовые кислоты выполняют следующие функции:
- Защитная — от ферментативного расщепления, обезвоживания, химического и теплового воздействия. Снижает эффективность гидрофобных антибиотиков. Позволяет патогену M. tuberculosis расти внутри макрофагов, пряча его от иммунной системы[4].
- Секреторная — участвуют в выделении фактора вирулентности микобактерий (например, липопротеина Ag85, M.tuberculosis)[4].
Химическая структура миколовых кислот тесно связана с вирулентностью, а любые изменения функциональных групп могут привести к подавлению роста in vivo. Более того, бактерии с мутациями в генах, отвечающих за синтез миколовых кислот проявляют иной тип укладывания в цепи (агрегаты бактерий) нежели дикий тип.
Клиническое значение
Миколовые кислоты необычным образом действуют на процессы воспаления. Например, путём введения мышам природных миколовых кислот удалось подавить у них искусственно вызванную астму и сопутствующий ей иммунный ответ[8]. Тем не менее природные экстракты миколовых кислот сильно гетерогенны и всё же могут вызывать воспаление. Для дальнейших тестов на биологическую активность из природной смеси методом органического синтеза были получены чистые гомологи различных природных миколовых кислот. Один из подклассов обладал очень эффективным противоастматическим действием, с совершенно новым механизмом действия. Сейчас эти соединения интенсивно исследуются. Второй подкласс, наоборот, запускал иммунный ответ (Т-хелперы 1 и Т-хелперы 17), так что эти вещества сейчас планируется использовать как адъюванты для разработки вакцины.
Международное многоцентровое исследование доказало, что деламанид, новый препарат класса нитродигидроимидазооксазолов, подавляет синтез миколовых кислот, и увеличивает конверсию культуры при лечения туберкулёза с множественной лекарственной устойчивостью на отрезке времени в 2 месяца[9].
Миколовые кислоты Rhodococcus
Миколовые кислоты представителей рода Rhodococcus, некоторым образом отличаются от таковых у M. tuberculosis. В них нет функциональных групп, но вместо этого есть несколько двойных связей. Существуют два профиля миколовых кислот Rhodococcus. К первому относятся жирные кислоты с длинной цепи от 28 до 46 атомов углерода и 0 — 1 ненасыщенной связью. Ко второму относятся жирные жирные кислоты из 34 — 54 атомов углерода с 0 — 4 ненасыщенными связями[10].
Примечания
- Шлегель Г. Общая микробиология. — М.: Мир, 1987. — С. 97. — 567 с.
- Katsube T, Matsumoto S, Takatsuka M, Okuyama M, Ozeki Y, Naito M, Nishiuchi Y, Fujiwara N, Yoshimura M, Tsuboi T, Torii M, Oshitani N, Arakawa T, Kobayashi K. J Bacteriol 2007 Nov; 189(22): 8241-8249
- de Souza Marcus Vinícius Nora, Ferreira Marcelle de Lima, Pinheiro Alessandra Campbell, Saraiva Maurício Frota, de Almeida Mauro Vieira, Valle Marcelo Siqueira. Synthesis and Biological Aspects of Mycolic Acids: An Important Target AgainstMycobacterium tuberculosis // The Scientific World JOURNAL. — 2008. — Т. 8. — С. 720—751. — ISSN 1537-744X. — doi:10.1100/tsw.2008.99.
- Takayama K., Wang C., Besra G. S. Pathway to Synthesis and Processing of Mycolic Acids in Mycobacterium tuberculosis (англ.) // Clinical Microbiology Reviews : journal. — 2005. — Vol. 18, no. 1. — P. 81—101. — doi:10.1128/CMR.18.1.81-101.2005. — PMID 15653820.
- Raman, K.; Rajagopalan, P.; Chandra, N. Flux Balance Analysis of Mycolic Acid Pathway: Targets for Anti-Tubercular Drugs (англ.) // PLoS Computational Biology : journal. — 2005. — Vol. 1, no. 5. — P. e46. — doi:10.1371/journal.pcbi.0010046. — PMID 16261191.
- Bhatt A., Molle V., Besra G. S., Jacobs W. R., Kremer L. The Mycobacterium tuberculosis FAS-II condensing enzymes: Their role in mycolic acid biosynthesis, acid-fastness, pathogenesis and in future drug development (англ.) // Molecular Microbiology : journal. — 2007. — Vol. 64, no. 6. — P. 1442—1454. — doi:10.1111/j.1365-2958.2007.05761.x. — PMID 17555433.
- David J., Lea-Smith J James S. Pyke, Dedreia Tull, Malcolm J. McConville, Ross L. Coppel, Paul K. Crellin. The Reductase That Catalyzes Mycolic Motif Synthesis Is Required for Efficient Attachment of Mycolic Acids to Arabinogalactan (англ.) // Journal of Biological Chemistry : journal. — 2007. — Vol. 282, no. 15. — P. 11000—11008. — doi:10.1074/jbc.M608686200. — PMID 17308303.
- Korf, J. E.; Pynaert, G.; Tournoy, K.; Boonefaes, T.; Van Oosterhout, A.; Ginneberge, D.; Haegeman, A.; Verschoor, J. A.; De Baetselier, P.; Grooten, J. Macrophage Reprogramming by Mycolic Acid Promotes a Tolerogenic Response in Experimental Asthma (англ.) // American Journal of Respiratory and Critical Care Medicine : journal. — 2006. — Vol. 174, no. 2. — P. 152—160. — doi:10.1164/rccm.200507-1175OC. — PMID 16675779.
- Gler, M. T.; Skripconoka, V.; Sanchez-Garavito, E.; Xiao, H.; Cabrera-Rivero, J. L.; Vargas-Vasquez, D. E.; Gao, M.; Awad, M.; Park, S. K.; Shim, T. S.; Suh, G. Y.; Danilovits, M.; Ogata, H.; Kurve, A.; Chang, J.; Suzuki, K.; Tupasi, T.; Koh, W. J.; Seaworth, B.; Geiter, L. J.; Wells, C. D. Delamanid for Multidrug-Resistant Pulmonary Tuberculosis (англ.) // New England Journal of Medicine : journal. — 2012. — Vol. 366, no. 23. — P. 2151—2160. — doi:10.1056/NEJMoa1112433. — PMID 22670901.
- Sutcliffe, L.C., Brown, A.K. & Dover, L.G. (2010). The Rhodococcal Cell Envelope: Composition, Organisation and Biosynthesis. Microbiol Monogr 16: 29-71.