Анаммокс
Анаммо́кс (сокр. от англ. anaerobic ammonium oxidation — анаэробное окисление аммония) — один из ключевых микробных процессов в круговороте азота[1]. Бактерии, осуществляющие этот процесс, были открыты в 1999 году, и в своё время описание этого процесса стало большим сюрпризом для научного сообщества[2]. Уравнение процесса:
- NH4+ + NO2− → N2 + 2H2O.

Этот процесс происходит во многих природных сообществах.
Общая характеристика процесса
В ходе анаммокса нитрит-ион и ион аммония превращаются непосредственно в молекулярный азот[3]:
- NH4+ + NO2− → N2 + 2H2O.
В масштабах планеты этот процесс даёт начало 30—50 % молекулярного азота, образующегося в океанах. В ходе анаммокса утилизируются соединения фиксированного азота в усваиваемой растениями форме и переводятся в неусваиваемую молекулярную форму, поэтому этот процесс ограничивает первичную продуктивность океана[4].
Бактерии, осуществляющие анаммокс, относятся к типу планктомицетов. На данный момент анаммокс описан у представителей 5 родов бактерий: Brocadia, Kuenenia, Anammoxoglobus, Jettenia (все пресноводные виды), а также Scalindua (морские представители)[6]. Для бактерий, осуществляющих анаммокс, характерно несколько отличительных черт: в их клетках всегда содержится единственная аннамоксосома — окружённый мембраной компартмент, в котором и происходит процесс анаммокса. Кроме того, их мембраны содержат особые ладдерановые липиды, обнаруженные лишь у этих организмов[7]. Особый интерес представляет образование гидразина как промежуточного соединения (это вещество используется как ракетное топливо и ядовито для большинства организмов)[8]. Наконец, эти бактерии отличаются поразительно низкой скоростью роста: время удвоения численности составляет 7—22 дней[5]. Они способны осуществлять превращения субстратов анаммокса даже при очень низкой их концентрации (менее микромолярных); иными словами, они отличаются очень высоким сродством к аммонию и нитриту[9][10]. Клетки, осуществляющие анаммокс, содержат очень много белков типа цитохрома с, которые составляют до 30 % всех клеточных белков. К их числу относятся и ферменты, осуществляющие ключевые катаболические реакции анаммокса; они придают клеткам характерный красный цвет[11]. Изначально считалось, что анаммокс происходит только при температурах 20—43 °C[9], однако в недавнее время анаммокс был описан в горячих источниках при температурах 36—52 °C[12] и в гидротермальных источниках вдоль Срединно-Атлантического хребта при температурах 60–85 °C[13].
История
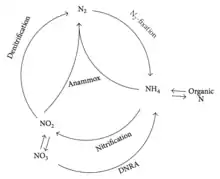
В 1932 году появились сообщения об образовании азота в ходе неизвестного процесса при брожении, которое происходило в иловых отложениях в озере Мендота (штат Висконсин, США)[14]. Более чем через 40 лет назад Ричардс заметил, что большая часть аммония, которая должна была бы образоваться при реминерализации органических остатков, пропадала[15]. Поскольку никаких биологических путей для осуществления таких превращений известно не было, поначалу биологическое анаэробное окисление получило мало внимания[1]. Тридцать лет назад при помощи термодинамических расчётов было предсказано существование двух хемолитоавтотрофных организмов, способных окислять аммиак до азота[16]. Долгое время, впрочем, считали, что биологическое окисление аммиака невозможно, поскольку многие предшествующие попытки найти биологическую основу этих реакций не увенчались успехом. В 1990-х годах наблюдения Арнольда Мадлера (англ. Arnold Mulder) подтвердили заключение Ричардса[17]. Эти учёные наблюдали, что в лишённой кислорода среде, содержащей бактерии, ионы аммония исчезают с видимым образованием азота. Этот процесс получил название анаммокс, и стало понятно, что он имеет огромное значение для разложения невостребованного аммония. Об открытии анаммокса было публично объявлено на Пятом биотехнологическом европейском конгрессе[18]. В середине 1990-х было сообщено об открытии анаммокса в реакторе с кипящим слоем (англ. fluidized bed reactor)[19]. В нём наибольшая скорость анаммокса составила 0,4 кг N/м3/d. Было показано, что для поглощения 1 моля аммония был необходимы 0,6 моля нитрата, в результате чего образовывалось 0,8 моля газообразного N2. В том же году была определена биологическая природа анаммокса[20]. Эксперименты с применением радиоактивных изотопов показали, что при использовании 15NH4+ и 14NO3− доминирующим продуктом был 14-15N2, который составлял 98,2 % всего меченного N2. Стало понятно, что в качестве агента, окисляющего аммиак, в анаммоксе использовался нитрит, а не нитрат. На основании предшествующих исследований Strous и коллеги, используя баланс взаимодействующих масс, рассчитали стехиометрию анаммокса[21], и их результаты получили широкую известность в других группах учёных. Позднее было определено, что бактерии, осуществляющие анаммокс, относятся к типу планктомицетов[2], и первый известный осуществляющий анаммокс организм получил название Candidatus Brocadia anammoxidans[22]. До 2002 года считалось, что анаммокс играет лишь небольшую роль в круговороте азота в природных экосистемах[23]. Однако в 2002 году установили, что анаммокс играет важную роль в биологическом цикле азота, на его долю приходится от 24 до 67 % общей продукции азота в осадочном слое континентальных шельфов[24]. Из-за этого представление об общем виде круговорота азота в природе несколько изменилось, как показано на рисунке.
Возможный механизм реакции
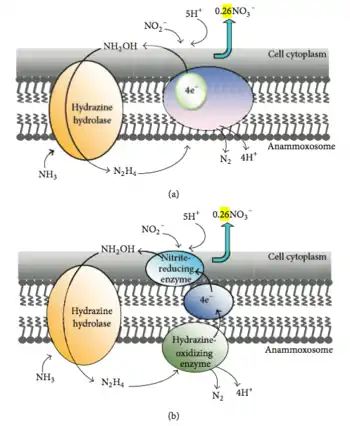
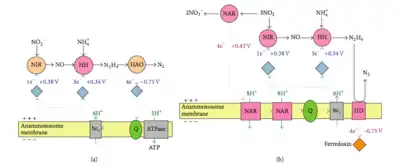
Согласно экспериментам с 15N, проведённым в 1997 году, в ходе анаммокса аммоний биологически окисляется до гидроксиламина, а в качестве возможного акцептора электронов выступает нитрит[25]. Считается, что электронные эквиваленты, необходимые для восстановления нитрита до гидроксиламина, образуются при превращении гидразина в молекулярный азот[26]. Предложено два возможных механизма этих реакций[26]. Согласно первому механизму, мембраносвязанный ферментный комплекс осуществляет превращение аммония и гидроксиламина в гидразин, который в периплазме окисляется до азота. В этот же момент цитоплазматическая сторона того же самого комплекса, который окисляет гидразин, и осуществляет внутренний перенос электронов. Второй механизм утверждает следующее. Аммоний и гидроксиламин превращает в гидразин мембраносвязанный ферментный комплекс, после чего гидразин окисляется до молекулярного азота в периплазматическом пространстве, а высвобожденные электроны через электронтранспортную цепь доставляются в цитоплазму к ферменту, восстанавливающему нитрит до гидроксиламина. Ещё нет ясности относительно того, происходит ли восстановление нитрита и окисление гидроксиламина в разных сайтах одного и того же фермента, или же эти реакции осуществляются двумя различными ферментными системами, соединёнными электронтранспортной цепью[26]. Микроорганизмы редко используют гидразин как промежуточное соединение в метаболизме азота[8]. Возможно, в нитрогеназной реакции именно он является связанным с ферментом промежуточным соединением[27].
Hooper и коллеги предположили, что, возможно, в анаммоксе принимают участие оксид азота NO и нитроксил HNO: NO или HNO конденсируется с аммонием под действием фермента, родственного ферментам семейства аммониймонооксигеназ[28]. Выделяющийся гидразин или имин может впоследствии превратиться в молекулярный азот под действием гидроксиламиноксидазы, а образующиеся восстановительные эквиваленты необходимы для реакции между NO или HNO с аммонием или же для восстановления нитрита до NO. Геномный анализ вида Candidatus Kuenenia stuttgartiensis показал, что у этого организма промежуточным соединением является не гидроксиламмоний, а NO; таким образом, у него имеет место близкий, но слегка отличающийся метаболический механизм[29]. Однако эта гипотеза не противоречит тому, что важным промежуточным соединением анаммокса является гидразин. С гидразином работают два фермента, уникальных для бактерий, осуществляющих анаммокс: гидразингидролаза (hh) и гидразиндегидрогеназа (hd). Hh образует гидразин из нитрита и аммония, а hd переносит электроны с гидразина на ферредоксин. Были определены несколько генов, которые участвуют в биосинтезе жирных кислот и S-аденозилметионина, которые содержат каталитические домены и домены, имеющие электрон-транспортную цепь[29].
Аэрация и добавление органических субстратов (обычно метанола) показало, что две стадии анаммокса, во-первых, являются чрезвычайно энергозатратными процессами, во-вторых, связаны с образованием излишков илистых отложений и, в-третьих, дают начало большим объёмам парниковых газов, таких как СО2, N2O и NO, поглощающий озон. Поскольку анаммокс-бактерии непосредственно превращают аммоний и нитрит в N2 в анаэробных условиях, этот процесс не нуждается в аэрации и добавлении других доноров электронов. Тем не менее, кислород необходим для образования нитрита бактериями, окисляющими аммоний. Однако в системах анаммокса с частичной нитрификацией потребность в кислороде значительно снижена, потому что только половина аммония окисляется до нитрита вместо полного превращения в нитрат[30].
Разнообразие видов
К настоящему моменту описано 10 видов, представители которых могут осуществлять анаммокс, причём семь из них могут быть выращены в лабораторной культуре[5]. Все они пока имеют таксономический статус Candidatus, поскольку ни один из них не удалось получить в чистой культуре. Известные виды распределены по 5 родам: Kuenenia (Kuenenia stuttgartiensis)[29], Brocadia (три вида: B. anammoxidans, B. fulgida и B. sinica)[2][31][32], Anammoxoglobus (A. propionicus)[33], Jettenia (J. asiatica[34][35]) и Scalindua (S. brodae, S. sorokinii, S. wagneri и S. profunda)[36][37][38]. Представители первых четырёх видов были выделены из осадков, покрывающих растения, использующиеся для очищения сточных вод. K. stuttgartiensis, B. anammoxidans, B. fulgida и A. propionicus были выделены из одной и той же посевной культуры. Scalindua населяет преимущественно морские воды, однако встречается также в пресноводных экосистемах и на растениях, очищающих сточные воды[36][39][40][41]. Эти 10 видов, судя по всему, представляют лишь малую долю биоразнообразия видов, осуществляющих анаммокс. Например, в базе данных GenBank в настоящее время содержится более 2000 генов 16S рРНК, выделенных из бактерий, осуществляющих анаммокс. Они принадлежат различным видам, подвидам и штаммам, которые сумели найти свою собственную видовую нишу среди различных сред обитания, населяемых бактериями, проводящими анаммокс. Видовое микроразнообразие особенно выражено у морского рода Scalindua[37][42][43][44][45][46].
Доля совпадения последовательностей 16S рРНК у анаммокс-бактерий составляет от 87 до 99 %, и филогенетические данные заставляют отнести их к филуму Planctomycetes[47], который образует суперфилум PVC вместе с филумами Verrucomicrobia и Chlamydiae[48]. В пределах Planctomycetes анаммокс-бактерии формируют рано отделившуюся монофилетическую кладу. Их филогенетические особенности вместе со специфическими клеточными, физиологическими и молекулярными свойствами заставляют выделить анаммокс-бактерии в порядок Brocadiales[49].
Применение
Анаммокс применяется для удаления аммония из сточных вод при их очистке и включает два раздельных процесса. Первый из них заключается в частичной нитрификации половины аммония до нитрита бактериями, окисляющими аммиак.
- 2NH4+ + 3O2 → 2NO2− + 4H+ + 2H2O
Далее остатки аммония и нитрит в ходе анаммокса, осуществляемого второй группой бактерий, превращаются в нитрат и молекулярный азот (выход около 15 %, не показано):
- NH4+ + NO2− → N2 + 2H2O
Оба процесса могут происходить в одном и том же реакторе, где бактерии двух разных групп формируют компактные гранулы[50][51].
Для получения гранулярной биомассы или биоплёнки из бактерий, осуществляющих анаммокс, необходимы специальные реакторы, причём в оптимальных условиях необходимый объём культуры может быть достигнут за 20 дней. Для выращивания анаммокс-бактерий подходят такие системы, как реактор переменного действия (англ. sequencing batch reactors, SBR), движущийся реактор с кипящим слоем (англ. moving bed reactor) и реакторы типа gas-lift-loop. Первый крупномасштабный реактор, предназначенный для выращивания анаммокс-бактерий, был построен в Нидерландах в 2002 году[52].
Анаммокс — торговое наименование технологии удаления аммиака, основанной на его анаэробном окислении и разработанной Делфтским техническим университетом[53].
Примечания
- Arrigo K. R. Marine microorganisms and global nutrient cycles. (англ.) // Nature. — 2005. — Vol. 437, no. 7057. — P. 349—355. — doi:10.1038/nature04159. — PMID 16163345.
- Strous M., Fuerst J. A., Kramer E. H., Logemann S., Muyzer G., van de Pas-Schoonen K. T., Webb R., Kuenen J. G., Jetten M. S. Missing lithotroph identified as new planctomycete. (англ.) // Nature. — 1999. — Vol. 400, no. 6743. — P. 446—449. — doi:10.1038/22749. — PMID 10440372.
- Reimann, Joachim; Jetten, Mike S.M.; Keltjens, Jan T. Chapter 7 Metal Enzymes in “Impossible” Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane // Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases (англ.) / Peter M.H. Kroneck and Martha E. Sosa Torres. — Springer, 2015. — Vol. 15. — P. 257—313. — (Metal Ions in Life Sciences). — doi:10.1007/978-3-319-12415-5_7.
- Devol A. H. Nitrogen cycle: Solution to a marine mystery. (англ.) // Nature. — 2003. — Vol. 422, no. 6932. — P. 575—576. — doi:10.1038/422575a. — PMID 12686985.
- Kartal B., de Almeida N. M., Maalcke W. J., Op den Camp H. J., Jetten M. S., Keltjens J. T. How to make a living from anaerobic ammonium oxidation. (англ.) // FEMS microbiology reviews. — 2013. — Vol. 37, no. 3. — P. 428—461. — doi:10.1111/1574-6976.12014. — PMID 23210799.
- Jetten M. S., Niftrik Lv, Strous M., Kartal B., Keltjens J. T., Op den Camp H. J. Biochemistry and molecular biology of anammox bacteria. (англ.) // Critical reviews in biochemistry and molecular biology. — 2009. — Vol. 44, no. 2-3. — P. 65—84. — doi:10.1080/10409230902722783. — PMID 19247843.
- Boumann H. A., Longo M. L., Stroeve P., Poolman B., Hopmans E. C., Stuart M. C., Sinninghe Damst J. S., Schouten S. Biophysical properties of membrane lipids of anammox bacteria: I. Ladderane phospholipids form highly organized fluid membranes. (англ.) // Biochimica et biophysica acta. — 2009. — Vol. 1788, no. 7. — P. 1444—1451. — doi:10.1016/j.bbamem.2009.04.008. — PMID 19376084.
- Schalk J., Oustad H., Kuenen J. G., Jetten M. S. The anaerobic oxidation of hydrazine: a novel reaction in microbial nitrogen metabolism. (англ.) // FEMS microbiology letters. — 1998. — Vol. 158, no. 1. — P. 61—67. — PMID 9453157.
- Strous M., Kuenen J. G., Jetten M. S. Key physiology of anaerobic ammonium oxidation. (англ.) // Applied and environmental microbiology. — 1999. — Vol. 65, no. 7. — P. 3248—3250. — PMID 10388731.
- Yan J., Haaijer S. C., Op den Camp H. J., van Niftrik L., Stahl D. A., Könneke M., Rush D., Sinninghe Damst J. S., Hu Y. Y., Jetten M. S. Mimicking the oxygen minimum zones: stimulating interaction of aerobic archaeal and anaerobic bacterial ammonia oxidizers in a laboratory-scale model system. (англ.) // Environmental microbiology. — 2012. — Vol. 14, no. 12. — P. 3146—3158. — doi:10.1111/j.1462-2920.2012.02894.x. — PMID 23057688.
- Kartal B., Maalcke W. J., de Almeida N. M., Cirpus I., Gloerich J., Geerts W., Op den Camp H. J., Harhangi H. R., Janssen-Megens E. M., Francoijs K. J., Stunnenberg H. G., Keltjens J. T., Jetten M. S., Strous M. Molecular mechanism of anaerobic ammonium oxidation. (англ.) // Nature. — 2011. — Vol. 479, no. 7371. — P. 127—130. — doi:10.1038/nature10453. — PMID 21964329.
- Jaeschke A., Op den Camp H. J., Harhangi H., Klimiuk A., Hopmans E. C., Jetten M. S., Schouten S., Sinninghe Damst J. S. 16S rRNA gene and lipid biomarker evidence for anaerobic ammonium-oxidizing bacteria (anammox) in California and Nevada hot springs. (англ.) // FEMS microbiology ecology. — 2009. — Vol. 67, no. 3. — P. 343—350. — doi:10.1111/j.1574-6941.2008.00640.x. — PMID 19220858.
- Byrne N., Strous M., Crépeau V., Kartal B., Birrien J. L., Schmid M., Lesongeur F., Schouten S., Jaeschke A., Jetten M., Prieur D., Godfroy A. Presence and activity of anaerobic ammonium-oxidizing bacteria at deep-sea hydrothermal vents. (англ.) // The ISME journal. — 2009. — Vol. 3, no. 1. — P. 117—123. — doi:10.1038/ismej.2008.72. — PMID 18670398.
- R. J. Allgeier, W. H. Peterson, C. Juday, E. A. Birge The anaerobic fermentation of lake deposits // International Review of Hydrobiology. — 1932. — Vol. 26, № 5—6. — P. 444—461. — doi:10.1002/iroh.19320260507.
- F. A. Richards. Anoxic basins and fjordsin // Chemical Oceanography / J.P. Ripley and G. Skirrow, Eds.. — London, UK: Academic Press, 1965. — P. 611—645.
- Broda E. Two kinds of lithotrophs missing in nature. (англ.) // Zeitschrift fur allgemeine Mikrobiologie. — 1977. — Vol. 17, no. 6. — P. 491—493. — PMID 930125.
- Kuenen J. G. Anammox bacteria: from discovery to application. (англ.) // Nature reviews. Microbiology. — 2008. — Vol. 6, no. 4. — P. 320—326. — doi:10.1038/nrmicro1857. — PMID 18340342.
- A. A. van de Graaf, A. Mulder, H. Slijkhuis, L. A. Robertson, J. G. Kuenen. Anoxic ammonium oxidation // Proceedings of the 5th European Congress on Biotechnology. — Copenhagen, Denmark: C. Christiansen, L. Munck, and J. Villadsen, Eds., 1990. — P. 338—391.
- A. Mulder, A. A. Van De Graaf, L. A. Robertson, J. G. Kuenen. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor // FEMS Microbiology Ecology. — 1995. — Vol. 16, № 3. — P. 177—184. — doi:10.1016/0168-6496(94)00081-7.
- van de Graaf A. A., Mulder A., de Bruijn P., Jetten M. S., Robertson L. A., Kuenen J. G. Anaerobic oxidation of ammonium is a biologically mediated process. (англ.) // Applied and environmental microbiology. — 1995. — Vol. 61, no. 4. — P. 1246—1251. — PMID 7747947.
- M. Strous, J. J. Heijnen, J. G. Kuenen, M. S. M. Jetten. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms (англ.) // Applied Microbiology and Biotechnology. — Springer, 1998. — Vol. 50, no. 5. — P. 589—596. — doi:10.1007/s002530051340.
- J. G. Kuenen, M. S. M. Jetten. Extraordinary anaerobic ammonium oxidising bacteria // ASM News. — 2001. — Vol. 67. — P. 456—463.
- Francis C. A., Beman J. M., Kuypers M. M. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation. (англ.) // The ISME journal. — 2007. — Vol. 1, no. 1. — P. 19—27. — doi:10.1038/ismej.2007.8. — PMID 18043610.
- Thamdrup B., Dalsgaard T. Production of N(2) through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments. (англ.) // Applied and environmental microbiology. — 2002. — Vol. 68, no. 3. — P. 1312—1318. — PMID 11872482.
- Van De Graaf, A. A. et al. Metabolic pathway of anaerobic ammonium oxidation on the basis of 15N studies in a fluidized bed reactor // Microbiology. — 1997. — Vol. 143, № 7. — P. 2415—2412. (недоступная ссылка)
- Ni S. Q., Zhang J. Anaerobic ammonium oxidation: from laboratory to full-scale application. (англ.) // BioMed research international. — 2013. — Vol. 2013. — P. 469360. — doi:10.1155/2013/469360. — PMID 23956985.
- Dilworth M. J., Eady R. R. Hydrazine is a product of dinitrogen reduction by the vanadium-nitrogenase from Azotobacter chroococcum. (англ.) // The Biochemical journal. — 1991. — Vol. 277 ( Pt 2). — P. 465—468. — PMID 1859374.
- Hooper A. B., Vannelli T., Bergmann D. J., Arciero D. M. Enzymology of the oxidation of ammonia to nitrite by bacteria. (англ.) // Antonie van Leeuwenhoek. — 1997. — Vol. 71, no. 1-2. — P. 59—67. — PMID 9049018.
- Strous M., Pelletier E., Mangenot S., Rattei T., Lehner A., Taylor M. W., Horn M., Daims H., Bartol-Mavel D., Wincker P., Barbe V., Fonknechten N., Vallenet D., Segurens B., Schenowitz-Truong C., Médigue C., Collingro A., Snel B., Dutilh B. E., Op den Camp H. J., van der Drift C., Cirpus I., van de Pas-Schoonen K. T., Harhangi H. R., van Niftrik L., Schmid M., Keltjens J., van de Vossenberg J., Kartal B., Meier H., Frishman D., Huynen M. A., Mewes H. W., Weissenbach J., Jetten M. S., Wagner M., Le Paslier D. Deciphering the evolution and metabolism of an anammox bacterium from a community genome. (англ.) // Nature. — 2006. — Vol. 440, no. 7085. — P. 790—794. — doi:10.1038/nature04647. — PMID 16598256.
- Hu Z., Lotti T., de Kreuk M., Kleerebezem R., van Loosdrecht M., Kruit J., Jetten M. S., Kartal B. Nitrogen removal by a nitritation-anammox bioreactor at low temperature. (англ.) // Applied and environmental microbiology. — 2013. — Vol. 79, no. 8. — P. 2807—2812. — doi:10.1128/AEM.03987-12. — PMID 23417008.
- Kartal B., van Niftrik L., Rattray J., van de Vossenberg J. L., Schmid M. C., Sinninghe Damst J., Jetten M. S., Strous M. Candidatus 'Brocadia fulgida': an autofluorescent anaerobic ammonium oxidizing bacterium. (англ.) // FEMS microbiology ecology. — 2008. — Vol. 63, no. 1. — P. 46—55. — doi:10.1111/j.1574-6941.2007.00408.x. — PMID 18081590.
- Oshiki M., Shimokawa M., Fujii N., Satoh H., Okabe S. Physiological characteristics of the anaerobic ammonium-oxidizing bacterium 'Candidatus Brocadia sinica'. (англ.) // Microbiology (Reading, England). — 2011. — Vol. 157, no. Pt 6. — P. 1706—1713. — doi:10.1099/mic.0.048595-0. — PMID 21474538.
- Kartal B., Rattray J., van Niftrik L. A., van de Vossenberg J., Schmid M. C., Webb R. I., Schouten S., Fuerst J. A., Damsté J. S., Jetten M. S., Strous M. Candidatus "Anammoxoglobus propionicus" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria. (англ.) // Systematic and applied microbiology. — 2007. — Vol. 30, no. 1. — P. 39—49. — doi:10.1016/j.syapm.2006.03.004. — PMID 16644170.
- Quan Z. X., Rhee S. K., Zuo J. E., Yang Y., Bae J. W., Park J. R., Lee S. T., Park Y. H. Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor. (англ.) // Environmental microbiology. — 2008. — Vol. 10, no. 11. — P. 3130—3139. — doi:10.1111/j.1462-2920.2008.01642.x. — PMID 18479446.
- Hu B. L., Rush D., van der Biezen E., Zheng P., van Mullekom M., Schouten S., Sinninghe Damst J. S., Smolders A. J., Jetten M. S., Kartal B. New anaerobic, ammonium-oxidizing community enriched from peat soil. (англ.) // Applied and environmental microbiology. — 2011. — Vol. 77, no. 3. — P. 966—971. — doi:10.1128/AEM.02402-10. — PMID 21148690.
- Schmid M., Walsh K., Webb R., Rijpstra W. I., van de Pas-Schoonen K., Verbruggen M. J., Hill T., Moffett B., Fuerst J., Schouten S., Damsté J. S., Harris J., Shaw P., Jetten M., Strous M. Candidatus "Scalindua brodae", sp. nov., Candidatus "Scalindua wagneri", sp. nov., two new species of anaerobic ammonium oxidizing bacteria. (англ.) // Systematic and applied microbiology. — 2003. — Vol. 26, no. 4. — P. 529—538. — PMID 14666981.
- Woebken D., Lam P., Kuypers M. M., Naqvi S. W., Kartal B., Strous M., Jetten M. S., Fuchs B. M., Amann R. A microdiversity study of anammox bacteria reveals a novel Candidatus Scalindua phylotype in marine oxygen minimum zones. (англ.) // Environmental microbiology. — 2008. — Vol. 10, no. 11. — P. 3106—3119. — doi:10.1111/j.1462-2920.2008.01640.x. — PMID 18510553.
- van de Vossenberg J., Woebken D., Maalcke W. J., Wessels H. J., Dutilh B. E., Kartal B., Janssen-Megens E. M., Roeselers G., Yan J., Speth D., Gloerich J., Geerts W., van der Biezen E., Pluk W., Francoijs K. J., Russ L., Lam P., Malfatti S. A., Tringe S. G., Haaijer S. C., Op den Camp H. J., Stunnenberg H. G., Amann R., Kuypers M. M., Jetten M. S. The metagenome of the marine anammox bacterium 'Candidatus Scalindua profunda' illustrates the versatility of this globally important nitrogen cycle bacterium. (англ.) // Environmental microbiology. — 2013. — Vol. 15, no. 5. — P. 1275—1289. — doi:10.1111/j.1462-2920.2012.02774.x. — PMID 22568606.
- Schubert C. J., Durisch-Kaiser E., Wehrli B., Thamdrup B., Lam P., Kuypers M. M. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika). (англ.) // Environmental microbiology. — 2006. — Vol. 8, no. 10. — P. 1857—1863. — doi:10.1111/j.1462-2920.2006.01074.x. — PMID 16958766.
- Hamersley M. R., Woebken D., Boehrer B., Schultze M., Lavik G., Kuypers M. M. Water column anammox and denitrification in a temperate permanently stratified lake (Lake Rassnitzer, Germany). (англ.) // Systematic and applied microbiology. — 2009. — Vol. 32, no. 8. — P. 571—582. — doi:10.1016/j.syapm.2009.07.009. — PMID 19716251.
- Ligi T. et al. The genetic potential of N2 emission via denitrification and ANAMMOX from the soils and sediments of a created riverine treatment wetland complex // Ecol. Eng.. — 2015. — Vol. 80. — P. 181—190.
- Schmid M. C., Risgaard-Petersen N., van de Vossenberg J., Kuypers M. M., Lavik G., Petersen J., Hulth S., Thamdrup B., Canfield D., Dalsgaard T., Rysgaard S., Sejr M. K., Strous M., den Camp H. J., Jetten M. S. Anaerobic ammonium-oxidizing bacteria in marine environments: widespread occurrence but low diversity. (англ.) // Environmental microbiology. — 2007. — Vol. 9, no. 6. — P. 1476—1484. — doi:10.1111/j.1462-2920.2007.01266.x. — PMID 17504485.
- Dang H., Chen R., Wang L., Guo L., Chen P., Tang Z., Tian F., Li S., Klotz M. G. Environmental factors shape sediment anammox bacterial communities in hypernutrified Jiaozhou Bay, China. (англ.) // Applied and environmental microbiology. — 2010. — Vol. 76, no. 21. — P. 7036—7047. — doi:10.1128/AEM.01264-10. — PMID 20833786.
- Hong Y. G., Li M., Cao H., Gu J. D. Residence of habitat-specific anammox bacteria in the deep-sea subsurface sediments of the South China Sea: analyses of marker gene abundance with physical chemical parameters. (англ.) // Microbial ecology. — 2011. — Vol. 62, no. 1. — P. 36—47. — doi:10.1007/s00248-011-9849-0. — PMID 21491114.
- Hong Y. G., Yin B., Zheng T. L. Diversity and abundance of anammox bacterial community in the deep-ocean surface sediment from equatorial Pacific. (англ.) // Applied microbiology and biotechnology. — 2011. — Vol. 89, no. 4. — P. 1233—1241. — doi:10.1007/s00253-010-2925-4. — PMID 20949269.
- Li M., Cao H., Hong Y., Gu J. D. Spatial distribution and abundances of ammonia-oxidizing archaea (AOA) and ammonia-oxidizing bacteria (AOB) in mangrove sediments. (англ.) // Applied microbiology and biotechnology. — 2011. — Vol. 89, no. 4. — P. 1243—1254. — doi:10.1007/s00253-010-2929-0. — PMID 20953601.
- Fuerst J. A., Sagulenko E. Beyond the bacterium: planctomycetes challenge our concepts of microbial structure and function. (англ.) // Nature reviews. Microbiology. — 2011. — Vol. 9, no. 6. — P. 403—413. — doi:10.1038/nrmicro2578. — PMID 21572457.
- Wagner M., Horn M. The Planctomycetes, Verrucomicrobia, Chlamydiae and sister phyla comprise a superphylum with biotechnological and medical relevance. (англ.) // Current opinion in biotechnology. — 2006. — Vol. 17, no. 3. — P. 241—249. — doi:10.1016/j.copbio.2006.05.005. — PMID 16704931.
- Jetten MSM, Op den Camp HJM, Kuenen JG & Strous M. Description of the order Brocadiales // Bergey’s Manual of Systematic Bacteriology. — Springer, Heidelberg, 2010. — Vol. 4. — P. 596—603.
- B. Kartal, G.J. Kuenen, M.C.M van Loosdrecht. Sewage Treatment with Anammox (англ.) // Science. — 2010. — Vol. 328. — P. 702—3.
- Knight, Helen. Bugs will give us free power while cleaning our sewage, New Scientist (7 мая 2010). Дата обращения 1 мая 2010.
- van der Star WRL, Abma WR, Blommers D, Mulder J-W, Tokutomi T, Strous M, Picioreanu C, Van Loosdrecht MCM. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam // Water Res. — 2007. — Vol. 41. — P. 4149—4163.
- Jetten Michael Silvester Maria, Van Loosdrecht Marinus Corneli; Technische Universiteit Delft, patent WO9807664 Архивировано 25 февраля 2012 года.
Литература
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — С. 179. — 384 с. — ISBN 978-5-7695-7979-0.