Циануксусная кислота
Циануксусная кислота (цианацетат, цианоэтановая кислота, мононитрил малоновой кислоты) — органическое вещество, нитрил малоновой кислоты.
| Циануксусная кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
2-Цианоэтановая кислота |
| Традиционные названия |
Циануксусная кислота, цианацетат, мононитрил малоновой кислоты |
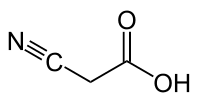
| Хим. формула | С3H3NO2 |
| Рац. формула | CNCH2COOH |
| Физические свойства | |
| Состояние | бесцветное кристаллическое вещество |
| Молярная масса | 85,06 г/моль |
| Плотность | 1,28 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 70-71 °C |
| • кипения | 108 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 3,56 |
| Растворимость | |
| • в воде | 100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 372-09-8 |
| PubChem | 9740 |
| Рег. номер EINECS | 206-743-9 |
| SMILES | |
| InChI | |
| ChEBI | 51889 |
| Номер ООН | 1759 |
| ChemSpider | 9357 |
| Безопасность | |
| ЛД50 |
200 мг/кг (мыши, внутрибрюшинно), 1500 мг/кг (крысы, перорально) |
| Токсичность | умеренно токсичное вещество, слаботоксична при пероральном и дермальном воздействии, довольно едкая. |
| Пиктограммы ECB |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физические свойства
Представляет собой бесцветное кристаллическое вещество, расплывающееся на воздухе[1]. Гигроскопичная. Хорошо растворяется в воде, полярных органических растворителях этиловом спирте, диэтиловом эфире, плохо в неполярных органических растворителях: алифатических углеводородах, бензоле, толуоле.
Химические свойства
Циануксусная кислота вследствие наличия нескольких функциональных групп вступает в различные химические реакции.
- По карбоксильной группе:
Проявляет все свойства характерные карбоновым кислотам — образует соли с металлами, сложные эфиры, амид, ангидрид, галогенангидриды и тд.
- По СN-группе:
Для нитрильной группы характерны реакции нуклеофильного замещения, в частности гидролиз.
Гидролиз циануксусной кислоты происходит в кислой среде, с образованием амида малоновой кислоты, который далее гидролизуется до малоновой кислоты:
В щелочной среде образуются соли малоновой кислоты:
Взаимодействие с аммиаком и аминами (первичными и вторичными) приводит к образованию амидинов
При нагревании выше 160 °С декарбоксилируется с образованием ацетонитрила:
Получение
Циануксусная кислота получается при взаимодействии хлоруксусной кислоты и цианида калия[1]:
В лаборатории возможно получение из щелочных солей циануксусной кислоты в растворе с серной кислотой при 30-35 °С[2]:
Применение
Широко используется в органическом синтезе. Эфиры циануксусной кислоты служат полупродуктами для синтеза цианакрилатных клеев, лекарственных средств (аллопуринола, витамина В1, кофеина и др.) и в качестве растворителей[3].
Токсикология
В отличие от нитрилов, циануксусная кислота слаботоксична[1] ЛД50 = 1,5 г/кг (крысы, перорально), для сравнения токсичность синильной кислоты почти в 1000 раз больше и составляет порядка 1,5-2 мг/кг. Довольная едкая, при попадании на кожу с высокой концентрацией может оставлять сильный ожог.
Примечания
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е, пер. и доп. В трех томах. Том I. Органические вещества. Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. Л., «Химия», 1976. 592 стр., 27 табл., библиография —1850 названий.
- Майофис Л.С. Технология химико-фармацевтических препаратов. — Л.: Медгиз, 1958. — 538 с.
- Козлова О.С. Основной органический синтез и нефтехимия Выпуск 25. — 1989. — 172 с.