Уравнение Ван-дер-Ваальса
Уравне́ние Ван-дер-Ва́альса (или уравне́ние Ван дер Ва́альса[К 1]) — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия становится функцией не только температуры, но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, описывающее свойства реального газа, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием[7].
Уравнение состояния
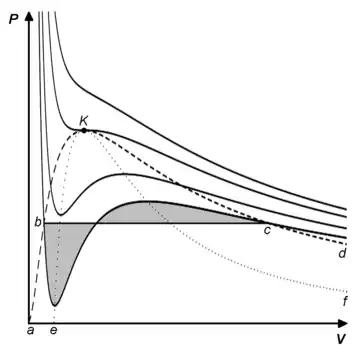
P — давление;
V — объём;
K — критическая точка;
abKcd — бинодаль (граница области двухфазного равновесия; область под колоколом бинодали — область двухфазного равновесия жидкость — пар);
eKf — спинодаль (граница между областями метастабильных и термодинамически неустойчивых состояний; область под колоколом спинодали — нереализуемые состояния);
bc — коннода (линия конденсации);
abKe — область перегретой жидкости;
dcKf — область переохлаждённого пара;
площади закрашенных фигур под изобарой bc и над ней равны (правило Максвелла, 1875)
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
где
- — давление,
- — молярный объём,
- — абсолютная температура,
- — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка — суммарный объём молекул газа.
Для молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
где
- — объём.
Из рисунка, на котором изображены изотермы газа Ван-дер-Ваальса, видно, что ниже некоторой температуры зависимость перестаёт быть монотонной: образуется петля Ван-дер-Ваальса, в которой увеличению давления соответствует увеличение объёма, что противоречит законам термодинамики. Появление петли означает, что уравнение Ван-дер-Ваальса в данной области изменения и перестаёт описывать действительную ситуацию, когда имеет место фазовый переход газ — жидкость и реальная изотерма представляет собой отрезок прямой — конноду (ноду), соединяющую две фигуративные точки на бинодали.
Вывод уравнения
Наиболее известны два способа получения уравнения: традиционный вывод самого Ван-дер-Ваальса и вывод методами статистической физики.
Традиционный вывод
Рассмотрим сначала газ, в котором частицы не взаимодействуют друг с другом, такой газ удовлетворяет уравнению состояния идеального газа:
Далее предположим, что частицы данного газа являются упругими сферами одинакового радиуса . Так как газ находится в сосуде конечного объёма, то пространство, где могут перемещаться частицы, будет несколько меньше. В исходной формуле следует вычесть из всего объёма некую его часть , которая, вообще говоря, зависит только от вещества, из которого состоит газ. Таким образом, получается следующее уравнение:
Стоит заметить, что вычитаемый объём не будет в точности равен суммарному объёму всех частиц. Если частицы считать твёрдыми и абсолютно упругими шариками, то вычитаемый объём будет примерно в четыре раза больше. Это легко объясняется тем, что центры упругих шаров не могут приближаться на расстояние ближе .
Далее Ван-дер-Ваальс рассматривает силы притяжения между частицами газа и делает следующие допущения:
- Частицы распределены равномерно по всему объёму.
- Силы притяжения стенок сосуда не учитываются, что в общем случае неверно.
- Частицы, находящиеся внутри сосуда и непосредственно у стенок, ощущают притяжение по-разному: внутри сосуда действующие силы притяжения других частиц компенсируют друг друга.
Таким образом, для частиц внутри сосуда силы притяжения не учитываются. Частицы, находящиеся непосредственно у края сосуда, затягиваются внутрь силой, пропорциональной концентрации:
- .
Число частиц, которые находятся непосредственно у стенок, в свою очередь тоже предполагается пропорциональным концентрации . Можно считать, что давление на стенки сосуда меньше на некоторую величину, обратно пропорциональную квадрату объёма:
Окончательное уравнение:
Если перейти от молярного объема к обычному, то получим:
Уравнение адиабаты для газа Ван-дер-Ваальса:
,
где
Внутренняя энергия газа Ван-дер-Ваальса
Потенциальная энергия межмолекулярных сил взаимодействия вычисляется как работа, которую совершают эти силы при разведении молекул на бесконечность:
Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моля газа:
где — молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
Критические параметры
Критическими параметрами газа называются значения его макропараметров (давления, объёма и температуры) в критической точке, то есть в таком состоянии, когда жидкая и газообразная фазы вещества неразличимы. Найдём эти параметры для газа Ван-дер-Ваальса, для чего преобразуем уравнение состояния:
Мы получили уравнение третьей степени относительно
В критической точке все три корня уравнения сливаются в один, поэтому предыдущее уравнение эквивалентно следующему:
Приравняв коэффициенты при соответствующих степенях , получим равенства:
Из них вычислим значения критических параметров…
…и критического коэффициента:
Приведённые параметры
Приведённые параметры определяются как отношения
Если подставить в уравнение Ван-дер-Ваальса получится приведённое уравнение состояния (для моль).
Стоит отметить, что если вещества обладают двумя одинаковыми приведёнными параметрами из трёх, то и третьи приведённые параметры у них совпадают.
Недостатки уравнения Ван-дер-Ваальса[8]
- 1. Для реальных веществ
- 2. Для реальных веществ (скорее, ).
- 3. Уравнение Ван-дер-Ваальса расходится с экспериментом в области двухфазных состояний.
См. также
Примечания
Комментарии
Источники
- Русский орфографический словарь: около 200 000 слов / Российская академия наук. Институт русского языка им. В. В. Виноградова / Под. ред. В. В. Лопатина, О. Е. Ивановой. — 4-е изд., испр. и доп. — М.: АСТ-Пресс Книга, 2013. — С. 68. — 896 с. — (Фундаментальные словари русского языка). — ISBN 978-5-462-01272-3.
- Мильчин А. Э., Чельцова Л. К. Артикли, предлоги, частицы ван, да, дас, де, дель, дер, ди, дос, дю, ла, ле, фон и т. п. в западноевропейских фамилиях и именах // Справочник издателя и автора. Редакционно-издательское оформление издания. — 2-е изд., испр. и доп.. — М.: Олма-Пресс, 2003. — 800 с. — 3000 экз. — ISBN 5-224-04565-7.
- Любитов Ю. Н. Ван-дер-Ваальса уравнение // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 240. — 704 с. — 100 000 экз.
- Анисимов М. А. Ван-дер-Ваальса уравнение // Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 352.
- Лопаткин А. А. Ван-дер-Ваальса уравнение // Большая Советская энциклопедия / Гл. ред. А. М. Прохоров. — М.: «Советская энциклопедия», 1971. — Т. 4.
- Башкиров А. Г. Ван дер Ваальса уравнение // Большая Российская энциклопедия / Гл. ред. Ю. С. Осипов. — М., 2006. — Т. 4. — С. 579. — 750 с. — 65 000 экз. — ISBN 5-85270-333-8.
- Матвеев, 1981.
- Матвеев, 1981, с. 245.
Литература
- Сивухин Д. В. Общий курс физики. — М.: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
- Матвеев А. Н. Молекулярная физика. — М.: Высшая школа, 1981. — С. 237-253. — 400 с.
- Atkins, P.W. and De Paula, J. Physical Chemistry. — W. H. Freeman, 2010. — Т. 1. — ISBN 9780199593361.
- Иванов В. К. Курс общей физики. Молекулярная физика (недоступная ссылка). Дата обращения: 6 ноября 2012. Архивировано 24 января 2010 года. (4.1. Взаимодействие молекул газа. Уравнение Ван-дер-Ваальса)