Ривароксабан
Рива́роксабан (кодовое название BAY 59-7939) — пероральный антикоагулянт из группы прямых ингибиторов фактора Xa. В частности, он используется для лечения тромбоза глубоких вен и легочной эмболии, а также для предотвращения образования тромбов при фибрилляции предсердий и после операций на бедре или колене[4].
| Ривароксабан | |
|---|---|
| лат. Rivaroxabanum | |
 | |
| Химическое соединение | |
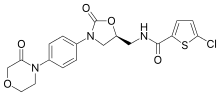
| ИЮПАК | (S)-5-хлоро-N-{[2-оксо-3-[4-(3-оксоморфолин-4-yl)фенил]оксазолидин-5-yl]метил} тиофен-2-карбоксамид |
| Брутто-формула | C19H18N3O5SCl |
| Молярная масса | 435.882 г/моль |
| CAS | 366789-02-8 |
| PubChem | 6433119 |
| DrugBank | DB06228 |
| Состав | |
| Классификация | |
| Фармакол. группа | Антикоагулянты[1] |
| АТХ | B01AF01 |
| МКБ-10 | I48, I80 |
| Фармакокинетика | |
| Биодоступн. | от 80% до 100% |
| Метаболизм | CYP3A4, CYP2J2 и CYP-независимые механизмы[2][3] |
| Период полувывед. |
от 5 до 9 часов у молодых пациентов; от 11 до 13 часов у пожилых пациентов[2][3] |
| Экскреция |
2/3 метаболизируется и выводится почками; 1/3 выводится кишечником в неизменном виде[2][3] |
| Лекарственные формы | |
| таблетки 2,5, 10, 15 и 20 мг | |
| Способы введения | |
| перорально | |
| Другие названия | |
| Ксарелто® | |
Общие побочные эффекты включают кровотечение[4]. Другие серьезные побочные эффекты могут включать гематому позвоночника и анафилаксию[4]. Неясно, безопасно ли использование во время беременности и кормления грудью[5]. По сравнению с варфарином, он меньше взаимодействует с другими лекарствами[6]. Он работает, блокируя активность фактора свертывания крови Ха[4].
Разработан и выпускается немецкой фармацевтической компанией Bayer под торговым названием «Ксарелто».
Применение в медицине
У пациентов с неклапанной фибрилляцией предсердий препарат столь же эффективен, как варфарин в предотвращении негеморрагических инсультов и тромбоэмболии.[7] Применение Ривароксабана связано с более низким риском сильных и смертельных кровотечений, чем варфарин. Хотя ривароксабан и связан с более высокой частотой кровотечений в желудочно-кишечном тракте.[8]
В июле 2012 года британский Национальный институт здравоохранения и медицины рекомендовал ривароксабан для профилактики и лечения венозной тромбоэмболии.[9]
Мерцательная аритмия
Разница в эффектах ПАНАВК (Пероральные антикоагулянты, не являющиеся антагонистами витамина К) и варфарина у людей с мерцательной аритмией, которым выполнили стентирование сосудов сердца, может быть незначительной или вообще отсутствовать. Тем не менее, ПАНАВК, вероятно, уменьшают потребность в госпитализации по сравнению с варфарином.
ПАНАВК могут быть безопаснее варфарина. Один из препаратов ПАНАВК (дабигатран) может снизить частоту как больших, так и малых кровотечений. Другие препараты ПАНАВК (апиксабан и ривароксабан), вероятно, снижают частоту небольших кровотечений. Существенной разницы между препаратами ПАНАВК в каких‐либо первичных или вторичных исходах не было.
Определённость доказательств варьировала от очень низкой до средней, что указывает на необходимость дополнительных исследований по этому вопросу[10][11].
Артроскопия коленного сустава
Существует небольшой риск того, что у здоровых взрослых пациентов, перенесших артроскопию коленного сустава, разовьется венозная тромбоэмболия (ТЭЛА или ТГВ). Имеются доказательства от умеренной до низкой достоверности об отсутствии пользы от использования низкомолекулярного гепарина (НМГ), аспирина или ривароксабана для снижения этого небольшого риска ТЭЛА или симптоматического ТГВ. Имеются очень низкие доказательства того, что использование НМГ может снизить риск бессимптомного ТГВ по сравнению с отсутствием лечения, но неясно, как это напрямую связано с частотой ТГВ или ТЭЛА у здоровых пациентов. Не было обнаружено никаких доказательств различий в побочных эффектах (включая большое и незначительное кровотечение), но данные, относящиеся к этому, были ограничены из-за небольшого количества событий в исследованиях, сообщающих в рамках сравнений[12][13].
Противопоказания
Из-за трудностей, связанных с контролем кровотечения, прием ривароксабана следует прекратить, по крайней мере, за 24 часа до операции, а затем снова начать, как только будет установлен адекватный гемостаз[14].
В рекомендациях по дозировке не рекомендуется назначать ривароксабан с лекарствами, которые, как известно, являются сильными комбинированными ингибиторами CYP3A4 / P-гликопротеина, поскольку это приводит к значительно более высоким концентрациям ривароксабана в плазме[15][16].
Побочные эффекты
Наиболее серьёзный побочный эффект — это кровотечения, включая тяжёлые внутренние кровотечения.[17][18][19] Применение Ривароксабана связано с более низким риском сильных и смертельных кровотечений, чем варфарин, но связан с более высокой частотой кровотечений в ЖКТ.
В октябре 2014 года, компания Портола Фармасьютикалз завершила фазы I и II клинических испытаний для andexanet Альфа в качестве антидота для ингибиторов фактора Ха с несколькими побочными эффектами, и начала исследования III фазы.[20][21] Andexanet Альфа, как ожидалось, будет утверждён в 2016 году.[22] Однако, в 2017 году соединение ещё не было одобрено FDA.
В 2015 году пост-маркетинговые исследования выявили токсичность для печени, и показали необходимость дальнейших исследований для количественной оценки риска.[23][24] Препарат противопоказан людям с серьёзными заболеваниями печени и терминальной стадии почечной болезни, при которых исследований не проводилось.
Ривароксабан в индивидуальной упаковке имеет предупреждение о том, что людям, использующим препарат, не следует прекращать его применения до консультации с врачом, так как это может увеличить риск инсульта.[25]
В 2015 году на ривароксабан приходится наибольшее количество зарегистрированных случаев серьёзных осложнений среди регулярно контролируемых FDA лекарств.[26]
Антидот
Специфическим антидотом ривороксабана является препарат Андекса (рекомбинантный инактивированный фактор Xa).
Механизм действия
Ривароксабан подавляет свободный фактор Ха и фактор Ха связанный в комплекс протромбиназы.[27] Это высокоселективный прямой ингибитор фактора Ха с пероральной биодоступностью и быстрым началом действия. Ингибирование фактора Ха прерывает внутренние и внешние пути свёртывания крови, препятствует образованию тромбина и развитию тромбов. Ривароксабан не подавляет тромбин (активированный фактор II) и не оказывает никакого влияния на тромбоциты[28]. Это позволяет легко корректировать дозы в антикоагулянтной терапии и отслеживать коагуляцию[28] , а также избегать ограничений в питании.[22]
Нефракционированный гепарин, низкомолекулярный гепарин и фондапаринукс также ингибируют активность фактора Ха, но косвенно, путём связывания циркулирующего антитромбина (АТ III). Принимая во внимание, что орально активный варфарин и аценокумарол являются антагонистами витамина К, уменьшая количество факторов свёртывания крови, включая фактор X.[29] Ривароксабан имеет предсказуемую фармакокинетику у широкого спектра пациентов (возраст, пол, вес, раса) и имеет линейную кривую доза-эффект в восьмикратном диапазоне доз (5-40 мг).[30]
Фармакодинамика
Фактор свёртывания крови X (фактор Стюарта—Прауэра) играет центральную роль в каскаде коагуляции, так как активируется и внешней, и внутренней теназой. Переходя в активную форму фактор X вместе с неферментным кофактором Va и Ca2+ образует на поверхности тромбоцитов или эндотелия протромбиназный комплекс, который в свою очередь катализирует процесс превращения протромбина в тромбин. Тромбин активирует полимеризацию растворимого фибриногена, приводя к формированию фибринового сгустка (тромба).
Механизм действия ривароксабан заключается в высокоселективном прямом ингибировании фактора свёртывания крови Ха, что позволяет одновременно заблокировать как внешний, так и внутренний пути коагуляции, и приостановить процесс тромбообразования.
Химия
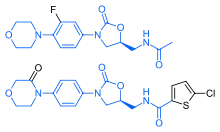
Ривароксабан имеет поразительное структурное сходство с антибиотиками группы линезолида: оба препарата имеют те же оксазолидинон-производные основные структуры. Соответственно, ривароксабан изучался на возможную противомикробную активность и митохондриальную токсичность, которая является известным осложнением долгосрочного применения линезолида. Исследования показали, что ни ривароксабан, ни его метаболиты не обладают антибактериальным действием против грам-положительных бактерий. Что касается митохондриальной токсичности, то в исследованиях In vitro, опубликованных до 2008 года выявленный риск был низким.[31]
Общество и культура
Экономика
Использование ривароксабана в 70 раз чаще варфарина, по данным Express Scripts Holding Co, крупнейшей в США компанией по работе с аптеками.[22] В 2016 году, Байер утверждал, что препарат был лицензирован в 130 странах и более 23 миллионов пациентов прошли лечение.[32]
Одобрение
В сентябре 2008 года, Министерство здравоохранения Канады выдало регистрационное удостоверение на ривароксабан для профилактики венозной тромбоэмболии у людей, которые прошли замену тазобедренного сустава или полное эндопротезирование коленного сустава.[33] В том же месяце Европейская комиссия также выдала регистрационное удостоверение ривароксабана для профилактики венозной тромбоэмболии у взрослых пациентов, перенёсших плановые операции бедра и коленного сустава.[34]
На 1 июля 2011 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США (FDA) одобрило ривароксабан для профилактики тромбоза глубоких вен (ТГВ), который может привести к тромбоэмболии лёгочной артерии (ТЭЛА), у взрослых, перенёсших эндопротезирование тазобедренного и коленного сустава.[35]
4 ноября 2011 года FDA США одобрило ривароксабан для профилактики инсульта у пациентов с неклапанной фибрилляцией предсердий.[36]
Исследования
Исследователи из Школы медицины Университета Дьюка были обвинены в сокрытии клинических данных, используемых для оценки ривароксабана[37]. Они проводили клинические испытания ривароксабана ROCKET AF.[38] В клиническом исследовании, опубликованном в 2011 году в медицинском журнале в Новой Англии[39], которое возглавил Роберт Калиффи, (представитель FDA[40])[39], нашли, что ривароксабан более эффективен, чем варфарин в снижении вероятности ишемических инсультов у пациентов с фибрилляцией предсердий.[39] Валидность исследования была поставлена под вопрос в 2014 году, когда фармацевтическими компаниями Байер и Джонсон и Джонсон было установлено, что использованные приборы мониторинга крови INRatio не функционируют должным образом[37][38]. Последующий анализ исследований Школы медицины Университета Дьюка, опубликованных в феврале 2016 года, обнаружил, что это не оказало существенного влияния на эффективность и безопасность испытаний.[41]
Примечания
- Ривароксабан (Rivaroxaban): инструкция, применение и формула. Энциклопедия лекарств и товаров аптечного ассортимента rlsnet.ru. Дата обращения: 31 марта 2015.
- Xarelto: Summary of Product Characteristics – EU (англ.). Официальный сайт Xarelto®. Дата обращения: 31 марта 2015.
- Ксарелто: Инструкция по применению, противопоказания, состав и цена, 3D-упаковка. Энциклопедия лекарств и товаров аптечного ассортимента rlsnet.ru. Дата обращения: 31 марта 2015.
- Rivaroxaban Monograph for Professionals. Drugs.com. American Society of Health-System Pharmacists. Дата обращения: 3 марта 2019.
- Rivaroxaban Use During Pregnancy. Drugs.com. Дата обращения: 3 марта 2019.
- Kiser, Kathryn. Oral Anticoagulation Therapy: Cases and Clinical Correlation. — Springer, 2017. — P. 11. — ISBN 9783319546438.
- Gómez-Outes, A; Terleira-Fernández, AI; Calvo-Rojas, G; Suárez-Gea, ML; Vargas-Castrillón, E. Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups. (англ.) // Thrombosis : journal. — 2013. — Vol. 2013. — P. 640723. — doi:10.1155/2013/640723. — PMID 24455237.
- Brown D.G., Wilkerson E.C., Love W.E. A review of traditional and novel oral anticoagulant and antiplatelet therapy for dermatologists and dermatologic surgeons (англ.) // Journal of the American Academy of Dermatology : journal. — 2015. — March (vol. 72, no. 3). — P. 524—534. — doi:10.1016/j.jaad.2014.10.027. — PMID 25486915.
- NICE guidance TA261 NICE guidance TA261. National Institute for Health and Clinical Excellence, July 2012
- Non‐vitamin K antagonist oral anticoagulants (NOACs) post‐percutaneous coronary intervention: a network meta‐analysis. Cochrane Library.
- Пероральные антикоагулянты, не являющиеся антагонистами витамина К (ПАНАВК), при чрескожном коронарном вмешательстве: сетевой мета‐анализ. Cochrane Library.
- Interventions for preventing venous thromboembolism in adults undergoing knee arthroscopy. Cochrane Library.
- Вмешательства для профилактики венозных тромбоэмболических осложнений у взрослых, перенесших артроскопическую операцию на коленном суставе. Cochrane Library.
- Sunkara T, Ofori E, Zarubin V, Caughey ME, Gaduputi V, Reddy M (2016). “Perioperative Management of Direct Oral Anticoagulants (DOACs): A Systemic Review”. Health Services Insights. 9 (Suppl 1): 25—36. DOI:10.4137/HSI.S40701. PMC 5156547. PMID 28008269.
- Xarelto- rivaroxaban tablet, film coated Xarelto- rivaroxaban tablet, film coated Xarelto- rivaroxaban kit. DailyMed. Дата обращения: 13 ноября 2020.
- Mueck W, Kubitza D, Becka M (September 2013). “Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects”. British Journal of Clinical Pharmacology. 76 (3): 455—66. DOI:10.1111/bcp.12075. PMC 3769672. PMID 23305158.
- Medication Guide--Xarelto. U.S. Food and Drug Administration. Дата обращения: 1 сентября 2014.
- Xarelto Side Effects. WebMD. Дата обращения: 1 сентября 2014.
- Xarelto Side Effects Center. RxList. Дата обращения: 1 сентября 2014.
- Schroeder C. Possible Antidote Could Help Blood Thinner Patients In Bleeding Emergencies. DrugNews. Дата обращения: 20 августа 2015.
- Mo Y., Yam F.K. Recent advances in the development of specific antidotes for target-specific oral anticoagulants (англ.) // Pharmacotherapy : journal. — 2015. — February (vol. 35, no. 2). — P. 198—207. — doi:10.1002/phar.1532. — PMID 25644580.
- Bill Berkrot New blood thinner 'antidote' to help doctors move past warfarin. Reuters (23 декабря 2015).
- Raschi, Emanuel; Poluzzi, Elisabetta; Koci, Ariola; Salvo, Francesco; Pariente, Antoine; Biselli, Maurizio; Moretti, Ugo; Moore, Nicholas; De Ponti, Fabrizio. Liver injury with novel oral anticoagulants: assessing post-marketing reports in the US Food and Drug Administration adverse event reporting system (англ.) // British Journal of Clinical Pharmacology : journal. — 2015. — 1 August (vol. 80, no. 2). — P. 285—293. — ISSN 1365-2125. — doi:10.1111/bcp.12611. — PMID 25689417.
- Russmann, Stefan; Niedrig, David F.; Budmiger, Mathias; Schmidt, Caroline; Stieger, Bruno; Hürlimann, Sandra; Kullak-Ublick, Gerd A. Rivaroxaban postmarketing risk of liver injury (неопр.) // Journal of Hepatology. — 2014. — 1 August (т. 61, № 2). — С. 293—300. — ISSN 1600-0641. — doi:10.1016/j.jhep.2014.03.026. — PMID 24681117.
- XARELTO (rivaroxaban) label. U.S. Food and Drug Association.
- Schroeder C. ISMP Ranks Xarelto Most Dangerous Drug in the United States. DrugNews. DrugNews. Дата обращения: 10 августа 2016.
- Roehrig S., Straub A., Pohlmann J., etal. Discovery of the novel antithrombotic agent 5-chloro-N-({(5S)-2-oxo-3- [4-(3-oxomorpholin-4-yl)phenyl]-1,3-oxazolidin-5-yl}methyl)thiophene- 2-carboxamide (BAY 59-7939): an oral, direct factor Xa inhibitor (англ.) // Journal of Medicinal Chemistry : journal. — 2005. — September (vol. 48, no. 19). — P. 5900—5908. — doi:10.1021/jm050101d. — PMID 16161994.
- Xarelto: Summary of Product Characteristics. Bayer Schering Pharma AG (2008). Дата обращения: 11 февраля 2009.
- Turpie A.G. New oral anticoagulants in atrial fibrillation (англ.) // European Heart Journal : journal. — 2008. — January (vol. 29, no. 2). — P. 155—165. — doi:10.1093/eurheartj/ehm575. — PMID 18096568.
- Eriksson B.I., Borris L.C., Dahl O.E., etal. A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement (англ.) // Circulation : journal. — Lippincott Williams & Wilkins, 2006. — November (vol. 114, no. 22). — P. 2374—2381. — doi:10.1161/CIRCULATIONAHA.106.642074. — PMID 17116766.
- European Medicines Agency. CHP Assessment Report for Xarelto (EMEA/543519/2008) (2008). Дата обращения: 11 июня 2009. (недоступная ссылка)
- Bayer comments on article in The British Medical Journal (BMJ) regarding Xarelto. Bayer AG Communications, Government Relations & Corporate Brand (29 сентября 2016).
- Bayer (2008-09-16). Bayer's Xarelto Approved in Canada. Пресс-релиз. Проверено 2010-01-31.
- Bayer (2008-02-10). Bayer’s Novel Anticoagulant Xarelto now also approved in the EU. Пресс-релиз. Архивировано из первоисточника 22 октября 2008. Проверено 2010-01-31.
- Janssen Pharmaceutica (2011-07-01). FDA Approves XARELTO® (rivaroxaban tablets) to Help Prevent Deep Vein Thrombosis in Patients Undergoing Knee or Hip Replacement Surgery. Пресс-релиз. Проверено 2011-07-01.
- FDA approves Xarelto to prevent stroke in people with common type of abnormal heart rhythm, U.S. Food and Drug Association (4 ноября 2011). Дата обращения 27 апреля 2016.
- Katie Thomas. Document Claims Drug Makers Deceived a Top Medical Journal. The New York Times. The New York Times. Дата обращения: 3 мая 2016.
- Vir Patel. Duke clinical trial under scrutiny in drug case. The Chronicle. Duke Student Publishing Company.
- Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. The New England Journal of Medicine. Massachusetts Medical Society.
- Meet Robert M. Califf, M.D., Commissioner of Food and Drugs. U.S. Food and Drug Administration. U.S. Food and Drug Administration. Дата обращения: 3 мая 2016.
- Point-of-Care Warfarin Monitoring in the ROCKET AF Trial. Massachusetts Medical Society (3 февраля 2016).
Ссылки
- Пероральные антикоагулянты, не являющиеся антагонистами витамина К (ПАНАВК), при чрескожном коронарном вмешательстве: сетевой мета‐анализ / Cochrane
- Вмешательства для профилактики венозных тромбоэмболических осложнений у взрослых, перенесших артроскопическую операцию на коленном суставе / Cochrane
- Ривароксабан связывается с белками в ПДБ (англ.)
- Xarelto — Информация о назначении (Европейский Союз) (англ.)
- Xarelto — Информация о назначении (США) (англ.)
- Ривароксабан (Rivaroxaban) — Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Действующее вещество