Определение конформации хромосом
Определе́ние конформа́ции хромосо́м, часто сокращённо называемые 3C (англ. chromosome conformation capture, 3C)[1] — набор методов молекулярной биологии, используемых для изучения пространственной организации хроматина в ядре клетки. Их применяют для количественной оценки взаимодействий между геномными локусами, расположенными рядом в трёхмерном пространстве[2].
Такие взаимодействия могут возникать как следствие биологических функций, например, между промотором и энхансером или в результате случайного образования петель полимера, когда физическое движение хроматина вызывает «столкновение» локусов[3]. При этом регуляторные элементы могут располагаться на расстоянии нескольких миллионов пар оснований от генов, которые они контролируют[4]. Несмотря на то, что локус-контролирующая область располагается на расстоянии нескольких десятков килобаз от генов, сложная конформация участка ДНК между ними позволяет им непосредственно взаимодействовать друг с другом, благодаря чему контролируется экспрессия генов[5].
Частоты взаимодействий могут быть проанализированы напрямую[6] или преобразованы в расстояния и использованы для реконструкции трёхмерных структур[7].
Основные различия методов на основе 3C — это их возможности и область применения[8]. Глубокое секвенирование материала, полученного с помощью 3C, также позволяет составить полногеномные карты взаимодействий.
История
Исторически микроскопия была основным методом исследования ядерной организации[9].
В 1984 году Джон Т. Лис разработал метод иммунопреципитации хроматина, принципы которого используются в ряде методов 3C. В 2002 году Джоб Деккер предложил идею использования матрицы плотности частот взаимодействия между локусами для определения пространственной организации геномов. Эта идея послужила основой для разработки метода 3C, первая статья о котором опубликована в 2002 году Джобом Деккером и профессором Нэнси Клекнер в Гарвардском университете[10][11]. Затем в 2006 году Марике Симонис разработала метод 4C[12], а Жози Дости — 5C[13]. Далее развиваются такие методы, как ChIP-seq[14], Hi-C[15] и ChIA-pet[16].
Экспериментальные методы
Все методы фиксации конформации хромосом начинаются с аналогичного набора манипуляций на начальном этапе, выполняемого на образце клеток.
- Обработка формальдегидом[17], который сшивает находящиеся рядом в пространстве участки генома, таким образом замораживая взаимодействия между локусами. Чаще всего используется 1—3 % формальдегид для фиксации в течение 10-30 минут при комнатной температуре[18]. Однако, необходима стандартизация для предотвращения сшивок белков с ДНК, которые могут мешать рестрикции на следующем этапе.
- Фрагментация с помощью эндонуклеаз рестрикции (рестриктаз). Итоговое разрешение определяется размером фрагментов. Для этой цели используют среднещепящие рестриктазы, которые распознают и режут 6 п.н. Например, EcoR1 или HindIII: они разрезают геном раз в каждые 4000 п.н. Таким образом, мы получаем около 1 миллиона фрагментов в случае генома человека[18][19].
- Случайное лигирование, которое производится при низких концентрациях ДНК в присутствии Т4 ДНК-лигазы[20]. В результате «склеиваются» концы сшитых ДНК. Низкие концентрации обеспечивают специфичность лигирования (только между сшитыми взаимодействующими фрагментами). Впоследствии взаимодействующие локусы количественно оценивают путем амплификации лигированных фрагментов с помощью ПЦР[18][20].
- Создание парной 3С библиотеки. Термическая обработка приводит к разрыву связей и образованию линейных химерных фрагментов ДНК. В результате будет создана библиотека взаимодействующих фрагментов ДНК (3C библиотека)[21].
- Real-time ПЦР позволяет оценивать вероятность взаимодействия двух конкретных участков генома. Производят подбор праймеров таким образом, что каждый праймер комплементарен своему, соответствующему локусу. В случае взаимодействия происходит отжиг обоих праймеров и амплификация фрагмента[8].
Базовые методы
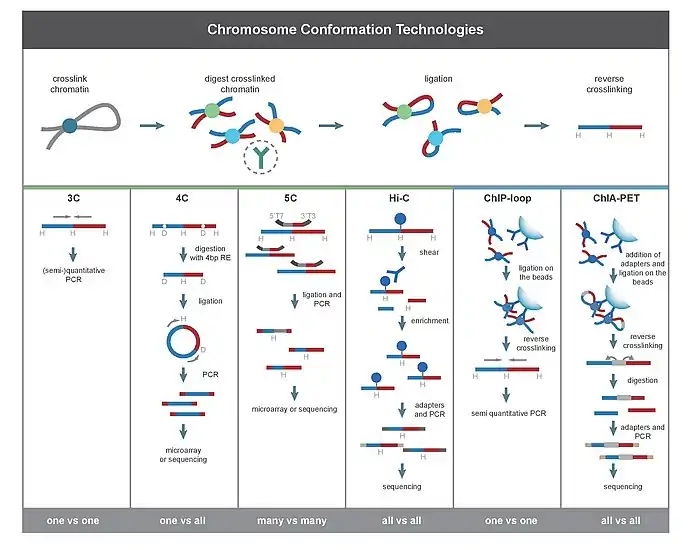
3C
Метод захвата конформации хромосомы (англ. chromosome conformation capture, 3C) необходим для количественного определения взаимодействия между выбранной парой геномных локусов. Например, 3C можно использовать для изучения потенциального взаимодействия промотор-энхансер. Лигированные фрагменты детектируют с помощью ПЦР, используя праймеры к известным последовательностям[10][2].
4C
Метод замкнутого захвата конформации хромосомы (англ. circularized chromosome conformation capture, 4С) охватывает взаимодействия между одним выбранным локусом и остальными геномными локусами. Он используется для того, чтобы найти участок генома, который взаимодействует с данной последовательностью ДНК[22] и представляет собой комбинацию стандартного метода 3С с инвертированной ПЦР.
Первые 4 этапа совпадают с этапами метода фиксации конформации хромосом. Далее последовательно проводятся фрагментация полученной 3С библиотеки рестриктазами; лигирование для циклизации фрагментов ДНК, в результате получая библиотеку «кольцевых» химерных ДНК (4C библиотека)[23]. Инвертированная ПЦР позволяет амплифицировать неизвестную последовательность, используя известную последовательность, лигированную с ней[12]. Анализ 4С библиотеки проводится с использованием ДНК-микрочипов.
В отличие от 3C и 5C, методы 4C не требуют предварительного знания нуклеотидных последовательностей обеих взаимодействующих хромосомных областей[8]. Результаты, полученные с помощью 4С, являются высоко воспроизводимыми для большинства взаимодействий между проксимальными областями. На одном микрочипе можно проанализировать около миллиона взаимодействий[1].
5C
5C детектирует взаимодействия между всеми фрагментами в заданном регионе, причём размер этого региона обычно не превышает мегабазы. Он позволяет искать участки ДНК, которые взаимодействуют с несколькими выбранными участками генома и представляет собой комбинацию метода 3С и мультиплексной ПЦР[13].
Первые 4 этапа совпадают с этапами метода фиксации конформации хромосом. Далее последовательно проводятся лигирование адаптеров ко всем фрагментам с использованием Taq-лигазы; анализ 5С библиотеки проводится с использованием ДНК-микрочипов и секвенирования[21]. 5С полезен для изучения сложных взаимодействий, однако, имеет относительно низкое покрытие. Метод не подходит для изучения комплексных взаимодействий по всему геному, поскольку для этого потребуются миллионы праймеров 5C[8].
Hi-C
Hi-C использует высокопроизводительное секвенирование для поиска нуклеотидной последовательности фрагментов[15]. В данном случае производится обработка рестриктазами фиксированного хроматина, биотинилирование концов и последующее случайное лигирование. Пара последовательностей независимо картируется на геном, что позволяет выделить фрагменты, задействованные в лигировании. Таким образом, проверяются все возможные парные взаимодействия между фрагментами[24].
Учёные пытаются установить границы применимости метода Hi-C на примере исследования, посвященного скринингу первичных опухолей головного мозга[25]. До онкоскрининга Hi-C в основном использовался для работ на клеточных линиях[26].
Специальные методы
К специальным методам можно отнести методы на основе захвата последовательности, single-cell методы и методы на основе иммунопреципитации. Например, single-cell Hi-C может быть использован для изучения взаимодействий в отдельных клетках[24].
Методы на основе захвата последовательности использует фиксацию олигонуклеотидов для обогащения библиотек 3C и Hi-C изучаемых локусов[27]. К ним относятся: Capture-C[28], NG Capture-C[29], Capture-3C[30] и Capture Hi-C[31]. Эти методы позволяют достигнуть более высокого разрешения и чувствительности, чем методы на основе 4C[8].
Методы на основе иммунопреципитации позволяют выделить локусы, которые взаимодействуют с помощью специфических белков, например, транскрипционных факторов или инсуляторных белков[32]. Среди них можно выделить такие методы, как ChIP-loop и ChIA-PET. ChIP-loop комбинирует 3C с ChIP-seq для детекции взаимодействия между двумя интересующими локусами, опосредованного изучаемым белком[33]. ChIA-PET сочетает Hi-C и ChIP-seq для детекции всех взаимодействий, опосредованных изучаемым белком[16][2].
Биологическое значение
Методы 3C способствовали большому числу важных биологических открытий, включая новые данные о структурных особенностях хромосом, классификацию хроматиновых петель, а также помогли углубить знания о механизмах регуляции транскрипции (чьё нарушение может приводить к целому ряду заболеваний)[9].
Методы захвата конформации хромосом продемонстрировали важность пространственной близости регуляторных элементов генов. Так, например, в тканях, экспрессирующих гены глобина, контрольный участок локуса β-глобина формирует петлю вместе с данными генами. При этом петля отсутствует в тканях, где этот ген не экспрессируется[34].
Фиксация конформации хромосом позволила обнаружить крупный уровень их организации — так называемые ТАДы (топологически ассоциированные домены), коррелирующие с изменениями в эпигенетических маркерах. Некоторые ТАДы не проявляют транскрипционной активности, в то время как активность других подавляется[35]. Большое количество ТАДов обнаружено у D. melanogaster, мыши и человека[36]. Основную роль в определении взаимодействий между ТАДами, энхансерами и промоторами играют транскрипционный фактор CTCF и белковый комплекс когезин. Результаты 3C экспериментов говорят о важности ориентации («лицом к лицу») связывающих мотивов CTCF и энхансер-промоторной петли. Это необходимо для корректного позиционирования энхансера относительно своей мишени[37].
Заболевания человека
Существует ряд болезней, вызываемых дефектами промотор-энхансерного взаимодействия[38]. К ним относится такое заболевание крови, как бета-талассемия, возникающее вследствие делеции энхансерного элемента ЛКО[39][40]. Мутация в SBE2 энхансере, которая, в свою очередь, ослабляет экспрессию гена SHH[41], приводит к развитию голопрозенцефалии. При этом нарушается формирование конечного мозга, разделённого на полушария. Другим примером связанных с изменением экспрессии SHH заболеваний является полидактилия второго типа PPD2 (трёхфаланговый большой палец). Она возникает из-за мутации регуляторного элемента ZRS, влияющего на усиленную продукцию SHH[42]. Расстройство взаимодействий между промотором и энхансером влияет не только на пороки развития, но также может служить причиной онкологических заболеваний. Так, аденокарцинома лёгкого может развиваться вследствие дупликации энхансерного элемента гена MYC[43]. T-клеточный острый лимфобластный лейкоз может быть вызван появлением нового энхансера из-за мутации в последовательности интрона[44].
Анализ данных
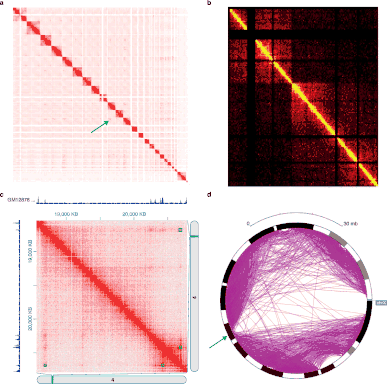
Данные, получающиеся в результате различных 3C экспериментов, характеризуются отличающимися структурой и статистическими свойствами. Поэтому для обработки каждого типа экспериментов существует свой программный пакет[27].
Данные Hi-C часто используются в анализе уровней полногеномной организации хроматина. В результате обработки существующими алгоритмами выделяются ТАДы, протяжённые линейные участки генома, которые связаны пространственно[45][35][6].
Hi-C и его производные постоянно совершенствуются. Fit-Hi-C[3] — это метод, основанный на принципе дискретного биннинга данных. Возможны его модификации с учётом расстояния взаимодействия (уточнение начального сплайна или spline-1) и уточнением нулевой модели (spline-2). Результатом Fit-Hi-C является список попарных интрахромосомных взаимодействий с соответствующими значениями p-value и q-value[46].
3D организация генома может быть установлена с использованием методов спектрального разложения матрицы контактов. Каждый собственный вектор соответствует набору локусов с общими структурными свойствами (эти локусы необязательно должны быть расположены линейно друг за другом)[47].
Одним из искажающих факторов для технологии 3C являются частые неспецифические взаимодействия между локусами, появляющиеся в результате случайного поведения полимера. Специфичность взаимодействия между двумя локусами обязательно должна быть подтверждена на соответствующем уровне статистической значимости[3].
Нормализация карты контактов Hi-C
Существует два основных пути нормализации первичных данных тепловой карты контактов Hi-C. Первый — предположение о равной доступности, что означает одинаковые шансы для каждой позиции в хромосоме участвовать во взаимодействии. Cоответственно, истинный сигнал карты контактов Hi-C должен представлять собой уравновешенную матрицу (уравновешенной матрицей считается такая, для которой суммы значений по строкам и столбцам равны). Примером такого алгоритма является алгоритм Синхорна-Кноппа, который приводит предварительную карту контактов к виду уравновешенной матрицы[48].
Другой способ использует предположение о том, что с каждой хромосомной позицией связана некоторая смещённость. Значение карты контактов для каждой координаты будет равняться истинному сигналу для данной позиции, умноженному на смещения для двух соседних позиций. К алгоритмам, использующим модель со смещением, относится алгоритм итеративной коррекции. В процессе его исполнения смещённость по строкам и столбцами итеративно исключается из первичной карты контактов[47].
Анализ мотивов ДНК
ДНК-мотивы — специфические короткие последовательности, часто длиной 8-20 нуклеотидов[49], которые статистически перепредставлены в наборе последовательностей с общей биологической функцией. На данный момент регуляторные мотивы дальних взаимодействий хроматина ещё не достаточно изучены[50].
Анализ раковых геномов
Техники, основанные на методах 3C, могут пролить свет на хромосомные перестройки в раковых геномах[25]. Более того, они способны показывать изменения в пространственной близости регуляторных элементов и их генов-мишеней, позволяя углубить понимание структурно-функциональной организации генома в целом[51].
См. также
Примечания
- de Wit E., de Laat W. A decade of 3C technologies: insights into nuclear organization (англ.) // Genes & Development. — 2012. — 1 January (vol. 26, no. 1). — P. 11—24. — ISSN 0890-9369. — doi:10.1101/gad.179804.111.
- Hakim Ofir, Misteli Tom. SnapShot: Chromosome Conformation Capture (англ.) // Cell. — 2012. — March (vol. 148, no. 5). — P. 1068—1068.e2. — ISSN 0092-8674. — doi:10.1016/j.cell.2012.02.019.
- Ay F., Bailey T. L., Noble W. S. Statistical confidence estimation for Hi-C data reveals regulatory chromatin contacts (англ.) // Genome Research. — 2014. — 5 February (vol. 24, no. 6). — P. 999—1011. — ISSN 1088-9051. — doi:10.1101/gr.160374.113.
- Dekker Job. The three 'C' s of chromosome conformation capture: controls, controls, controls (англ.) // Nature Methods. — 2005. — 20 December (vol. 3, no. 1). — P. 17—21. — ISSN 1548-7091. — doi:10.1038/nmeth823.
- Dekker Job. A closer look at long-range chromosomal interactions (англ.) // Trends in Biochemical Sciences. — 2003. — June (vol. 28, no. 6). — P. 277—280. — ISSN 0968-0004. — doi:10.1016/S0968-0004(03)00089-6.
- Rao Suhas S.P., Huntley Miriam H., Durand Neva C., Stamenova Elena K., Bochkov Ivan D., Robinson James T., Sanborn Adrian L., Machol Ido, Omer Arina D., Lander Eric S., Aiden Erez Lieberman. A 3D Map of the Human Genome at Kilobase Resolution Reveals Principles of Chromatin Looping (англ.) // Cell. — 2014. — December (vol. 159, no. 7). — P. 1665—1680. — ISSN 0092-8674. — doi:10.1016/j.cell.2014.11.021.
- Varoquaux N., Ay F., Noble W. S., Vert J.-P. A statistical approach for inferring the 3D structure of the genome (англ.) // Bioinformatics. — 2014. — 15 June (vol. 30, no. 12). — P. i26—i33. — ISSN 1367-4803. — doi:10.1093/bioinformatics/btu268.
- Davies James O J, Oudelaar A Marieke, Higgs Douglas R, Hughes Jim R. How best to identify chromosomal interactions: a comparison of approaches (англ.) // Nature Methods. — 2017. — February (vol. 14, no. 2). — P. 125—134. — ISSN 1548-7091. — doi:10.1038/nmeth.4146.
- Denker Annette, de Laat Wouter. The second decade of 3C technologies: detailed insights into nuclear organization (англ.) // Genes & Development. — 2016. — 15 June (vol. 30, no. 12). — P. 1357—1382. — ISSN 0890-9369. — doi:10.1101/gad.281964.116.
- Dekker J. Capturing Chromosome Conformation (англ.) // Science. — 2002. — 15 February (vol. 295, no. 5558). — P. 1306—1311. — ISSN 0036-8075. — doi:10.1126/science.1067799.
- Osborne C. S., Ewels P. A., Young A. N. C. Meet the neighbours: tools to dissect nuclear structure and function (англ.) // Briefings in Functional Genomics. — 2011. — 1 January (vol. 10, no. 1). — P. 11—17. — ISSN 2041-2649. — doi:10.1093/bfgp/elq034.
- Simonis Marieke, Klous Petra, Splinter Erik, Moshkin Yuri, Willemsen Rob, de Wit Elzo, van Steensel Bas, de Laat Wouter. Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture–on-chip (4C) (англ.) // Nature Genetics. — 2006. — 8 October (vol. 38, no. 11). — P. 1348—1354. — ISSN 1061-4036. — doi:10.1038/ng1896.
- Dostie J., Richmond T. A., Arnaout R. A., Selzer R. R., Lee W. L., Honan T. A., Rubio E. D., Krumm A., Lamb J., Nusbaum C., Green R. D., Dekker J. Chromosome Conformation Capture Carbon Copy (5C): A massively parallel solution for mapping interactions between genomic elements (англ.) // Genome Research. — 2006. — 1 October (vol. 16, no. 10). — P. 1299—1309. — ISSN 1088-9051. — doi:10.1101/gr.5571506.
- Albert Istvan, Mavrich Travis N., Tomsho Lynn P., Qi Ji, Zanton Sara J., Schuster Stephan C., Pugh B. Franklin. Translational and rotational settings of H2A.Z nucleosomes across the Saccharomyces cerevisiae genome (англ.) // Nature. — 2007. — March (vol. 446, no. 7135). — P. 572—576. — ISSN 0028-0836. — doi:10.1038/nature05632.
- Lieberman-Aiden E., van Berkum N. L., Williams L., Imakaev M., Ragoczy T., Telling A., Amit I., Lajoie B. R., Sabo P. J., Dorschner M. O., Sandstrom R., Bernstein B., Bender M. A., Groudine M., Gnirke A., Stamatoyannopoulos J., Mirny L. A., Lander E. S., Dekker J. Comprehensive Mapping of Long-Range Interactions Reveals Folding Principles of the Human Genome (англ.) // Science. — 2009. — 8 October (vol. 326, no. 5950). — P. 289—293. — ISSN 0036-8075. — doi:10.1126/science.1181369.
- Fullwood Melissa J., Liu Mei Hui, Pan You Fu, Liu Jun, Xu Han, Mohamed Yusoff Bin, Orlov Yuriy L., Velkov Stoyan, Ho Andrea, Mei Poh Huay, Chew Elaine G. Y., Huang Phillips Yao Hui, Welboren Willem-Jan, Han Yuyuan, Ooi Hong Sain, Ariyaratne Pramila N., Vega Vinsensius B., Luo Yanquan, Tan Peck Yean, Choy Pei Ye, Wansa K. D. Senali Abayratna, Zhao Bing, Lim Kar Sian, Leow Shi Chi, Yow Jit Sin, Joseph Roy, Li Haixia, Desai Kartiki V., Thomsen Jane S., Lee Yew Kok, Karuturi R. Krishna Murthy, Herve Thoreau, Bourque Guillaume, Stunnenberg Hendrik G., Ruan Xiaoan, Cacheux-Rataboul Valere, Sung Wing-Kin, Liu Edison T., Wei Chia-Lin, Cheung Edwin, Ruan Yijun. An oestrogen-receptor-α-bound human chromatin interactome (англ.) // Nature. — 2009. — November (vol. 462, no. 7269). — P. 58—64. — ISSN 0028-0836. — doi:10.1038/nature08497.
- Gavrilov Alexey, Eivazova Elvira, Pirozhkova Iryna, Lipinski Marc, Razin Sergey, Vassetzky Yegor. Chromosome Conformation Capture (from 3C to 5C) and Its ChIP-Based Modification (англ.) // Chromatin Immunoprecipitation Assays. — 2009. — P. 171—188. — ISBN 9781603274135. — ISSN 1064-3745. — doi:10.1007/978-1-60327-414-2_12.
- Naumova Natalia, Smith Emily M., Zhan Ye, Dekker Job. Analysis of long-range chromatin interactions using Chromosome Conformation Capture (англ.) // Methods. — 2012. — November (vol. 58, no. 3). — P. 192—203. — ISSN 1046-2023. — doi:10.1016/j.ymeth.2012.07.022.
- Belton Jon-Matthew, Dekker Job. Chromosome Conformation Capture (3C) in Budding Yeast (англ.) // Cold Spring Harbor Protocols. — 2015. — June (vol. 2015, no. 6). — P. pdb.prot085175. — ISSN 1940-3402. — doi:10.1101/pdb.prot085175.
- Gavrilov Alexey A., Golov Arkadiy K., Razin Sergey V. Actual Ligation Frequencies in the Chromosome Conformation Capture Procedure (англ.) // PLoS ONE. — 2013. — 26 March (vol. 8, no. 3). — P. e60403. — ISSN 1932-6203. — doi:10.1371/journal.pone.0060403.
- Stadhouders Ralph, Kolovos Petros, Brouwer Rutger, Zuin Jessica, van den Heuvel Anita, Kockx Christel, Palstra Robert-Jan, Wendt Kerstin S, Grosveld Frank, van Ijcken Wilfred, Soler Eric. Multiplexed chromosome conformation capture sequencing for rapid genome-scale high-resolution detection of long-range chromatin interactions (англ.) // Nature Protocols. — 2013. — 14 February (vol. 8, no. 3). — P. 509—524. — ISSN 1754-2189. — doi:10.1038/nprot.2013.018.
- Zhao Zhihu, Tavoosidana Gholamreza, Sjölinder Mikael, Göndör Anita, Mariano Piero, Wang Sha, Kanduri Chandrasekhar, Lezcano Magda, Singh Sandhu Kuljeet, Singh Umashankar, Pant Vinod, Tiwari Vijay, Kurukuti Sreenivasulu, Ohlsson Rolf. Circular chromosome conformation capture (4C) uncovers extensive networks of epigenetically regulated intra- and interchromosomal interactions (англ.) // Nature Genetics. — 2006. — 8 October (vol. 38, no. 11). — P. 1341—1347. — ISSN 1061-4036. — doi:10.1038/ng1891.
- van de Werken Harmen J G, Landan Gilad, Holwerda Sjoerd J B, Hoichman Michael, Klous Petra, Chachik Ran, Splinter Erik, Valdes-Quezada Christian, Öz Yuva, Bouwman Britta A M, Verstegen Marjon J A M, de Wit Elzo, Tanay Amos, de Laat Wouter. Robust 4C-seq data analysis to screen for regulatory DNA interactions (англ.) // Nature Methods. — 2012. — 9 September (vol. 9, no. 10). — P. 969—972. — ISSN 1548-7091. — doi:10.1038/nmeth.2173.
- Nagano Takashi, Lubling Yaniv, Stevens Tim J., Schoenfelder Stefan, Yaffe Eitan, Dean Wendy, Laue Ernest D., Tanay Amos, Fraser Peter. Single-cell Hi-C reveals cell-to-cell variability in chromosome structure (англ.) // Nature. — 2013. — 25 September (vol. 502, no. 7469). — P. 59—64. — ISSN 0028-0836. — doi:10.1038/nature12593.
- Harewood Louise, Kishore Kamal, Eldridge Matthew D., Wingett Steven, Pearson Danita, Schoenfelder Stefan, Collins V. Peter, Fraser Peter. Hi-C as a tool for precise detection and characterisation of chromosomal rearrangements and copy number variation in human tumours (англ.) // Genome Biology. — 2017. — 27 June (vol. 18, no. 1). — ISSN 1474-760X. — doi:10.1186/s13059-017-1253-8.
- Burton Joshua N, Adey Andrew, Patwardhan Rupali P, Qiu Ruolan, Kitzman Jacob O, Shendure Jay. Chromosome-scale scaffolding of de novo genome assemblies based on chromatin interactions (англ.) // Nature Biotechnology. — 2013. — 3 November (vol. 31, no. 12). — P. 1119—1125. — ISSN 1087-0156. — doi:10.1038/nbt.2727.
- Schmitt Anthony D., Hu Ming, Ren Bing. Genome-wide mapping and analysis of chromosome architecture (англ.) // Nature Reviews Molecular Cell Biology. — 2016. — 1 September (vol. 17, no. 12). — P. 743—755. — ISSN 1471-0072. — doi:10.1038/nrm.2016.104.
- Hughes Jim R, Roberts Nigel, McGowan Simon, Hay Deborah, Giannoulatou Eleni, Lynch Magnus, De Gobbi Marco, Taylor Stephen, Gibbons Richard, Higgs Douglas R. Analysis of hundreds of cis-regulatory landscapes at high resolution in a single, high-throughput experiment (англ.) // Nature Genetics. — 2014. — 12 January (vol. 46, no. 2). — P. 205—212. — ISSN 1061-4036. — doi:10.1038/ng.2871.
- Davies James O J, Telenius Jelena M, McGowan Simon J, Roberts Nigel A, Taylor Stephen, Higgs Douglas R, Hughes Jim R. Multiplexed analysis of chromosome conformation at vastly improved sensitivity (англ.) // Nature Methods. — 2015. — 23 November (vol. 13, no. 1). — P. 74—80. — ISSN 1548-7091. — doi:10.1038/nmeth.3664.
- the GIANT Consortium. Six new loci associated with body mass index highlight a neuronal influence on body weight regulation (англ.) // Nature Genetics. — 2008. — 14 December (vol. 41, no. 1). — P. 25—34. — ISSN 1061-4036. — doi:10.1038/ng.287.
- Jäger Roland, Migliorini Gabriele, Henrion Marc, Kandaswamy Radhika, Speedy Helen E., Heindl Andreas, Whiffin Nicola, Carnicer Maria J., Broome Laura, Dryden Nicola, Nagano Takashi, Schoenfelder Stefan, Enge Martin, Yuan Yinyin, Taipale Jussi, Fraser Peter, Fletcher Olivia, Houlston Richard S. Capture Hi-C identifies the chromatin interactome of colorectal cancer risk loci (англ.) // Nature Communications. — 2015. — 19 February (vol. 6, no. 1). — ISSN 2041-1723. — doi:10.1038/ncomms7178.
- Tiwari V. K., Baylin S. B. Combined 3C-ChIP-Cloning (6C) Assay: A Tool to Unravel Protein-Mediated Genome Architecture (англ.) // Cold Spring Harbor Protocols. — 2009. — 1 March (vol. 2009, no. 3). — P. pdb.prot5168—pdb.prot5168. — ISSN 1559-6095. — doi:10.1101/pdb.prot5168.
- Horike Shin-ichi, Cai Shutao, Miyano Masaru, Cheng Jan-Fang, Kohwi-Shigematsu Terumi. Loss of silent-chromatin looping and impaired imprinting of DLX5 in Rett syndrome (англ.) // Nature Genetics. — 2004. — 19 December (vol. 37, no. 1). — P. 31—40. — ISSN 1061-4036. — doi:10.1038/ng1491.
- Tolhuis Bas, Palstra Robert-Jan, Splinter Erik, Grosveld Frank, de Laat Wouter. Looping and Interaction between Hypersensitive Sites in the Active β-globin Locus (англ.) // Molecular Cell. — 2002. — December (vol. 10, no. 6). — P. 1453—1465. — ISSN 1097-2765. — doi:10.1016/S1097-2765(02)00781-5.
- Cavalli Giacomo, Misteli Tom. Functional implications of genome topology (англ.) // Nature Structural & Molecular Biology. — 2013. — March (vol. 20, no. 3). — P. 290—299. — ISSN 1545-9993. — doi:10.1038/nsmb.2474.
- Dekker Job, Marti-Renom Marc A., Mirny Leonid A. Exploring the three-dimensional organization of genomes: interpreting chromatin interaction data (англ.) // Nature Reviews Genetics. — 2013. — 9 May (vol. 14, no. 6). — P. 390—403. — ISSN 1471-0056. — doi:10.1038/nrg3454.
- Guo Ya, Xu Quan, Canzio Daniele, Shou Jia, Li Jinhuan, Gorkin David U., Jung Inkyung, Wu Haiyang, Zhai Yanan, Tang Yuanxiao, Lu Yichao, Wu Yonghu, Jia Zhilian, Li Wei, Zhang Michael Q., Ren Bing, Krainer Adrian R., Maniatis Tom, Wu Qiang. CRISPR Inversion of CTCF Sites Alters Genome Topology and Enhancer/Promoter Function (англ.) // Cell. — 2015. — August (vol. 162, no. 4). — P. 900—910. — ISSN 0092-8674. — doi:10.1016/j.cell.2015.07.038.
- Krijger Peter Hugo Lodewijk, de Laat Wouter. Regulation of disease-associated gene expression in the 3D genome (англ.) // Nature Reviews Molecular Cell Biology. — 2016. — 9 November (vol. 17, no. 12). — P. 771—782. — ISSN 1471-0072. — doi:10.1038/nrm.2016.138.
- Fritsch E. F., Lawn R. M., Maniatis T. Characterisation of deletions which affect the expression of fetal globin genes in man. (англ.) // Nature. — 1979. — 14 June (vol. 279, no. 5714). — P. 598—603. — PMID 450109.
- Van der Ploeg L. H., Konings A., Oort M., Roos D., Bernini L., Flavell R. A. gamma-beta-Thalassaemia studies showing that deletion of the gamma- and delta-genes influences beta-globin gene expression in man. (англ.) // Nature. — 1980. — 14 February (vol. 283, no. 5748). — P. 637—642. — PMID 6153459.
- Jeong Y. A functional screen for sonic hedgehog regulatory elements across a 1 Mb interval identifies long-range ventral forebrain enhancers (англ.) // Development. — 2006. — 15 February (vol. 133, no. 4). — P. 761—772. — ISSN 0950-1991. — doi:10.1242/dev.02239.
- Wieczorek Dagmar, Pawlik Barbara, Li Yun, Akarsu Nurten A., Caliebe Almuth, May Klaus J.W., Schweiger Bernd, Vargas Fernando R., Balci Sevim, Gillessen-Kaesbach Gabriele, Wollnik Bernd. A specific mutation in the distant sonic hedgehog (SHH)cis-regulator (ZRS) causes Werner mesomelic syndrome (WMS) while complete ZRS duplications underlie Haas type polysyndactyly and preaxial polydactyly (PPD) with or without triphalangeal thumb (англ.) // Human Mutation. — 2010. — January (vol. 31, no. 1). — P. 81—89. — ISSN 1059-7794. — doi:10.1002/humu.21142.
- Zhang Xiaoyang, Choi Peter S, Francis Joshua M, Imielinski Marcin, Watanabe Hideo, Cherniack Andrew D, Meyerson Matthew. Identification of focally amplified lineage-specific super-enhancers in human epithelial cancers (англ.) // Nature Genetics. — 2015. — 14 December (vol. 48, no. 2). — P. 176—182. — ISSN 1061-4036. — doi:10.1038/ng.3470.
- Mansour M. R., Abraham B. J., Anders L., Berezovskaya A., Gutierrez A., Durbin A. D., Etchin J., Lawton L., Sallan S. E., Silverman L. B., Loh M. L., Hunger S. P., Sanda T., Young R. A., Look A. T. An oncogenic super-enhancer formed through somatic mutation of a noncoding intergenic element (англ.) // Science. — 2014. — 13 November (vol. 346, no. 6215). — P. 1373—1377. — ISSN 0036-8075. — doi:10.1126/science.1259037.
- Dixon Jesse R., Selvaraj Siddarth, Yue Feng, Kim Audrey, Li Yan, Shen Yin, Hu Ming, Liu Jun S., Ren Bing. Topological domains in mammalian genomes identified by analysis of chromatin interactions (англ.) // Nature. — 2012. — 11 April (vol. 485, no. 7398). — P. 376—380. — ISSN 0028-0836. — doi:10.1038/nature11082.
- Yardımcı Galip Gürkan, Noble William Stafford. Software tools for visualizing Hi-C data (англ.) // Genome Biology. — 2017. — 3 February (vol. 18, no. 1). — ISSN 1474-760X. — doi:10.1186/s13059-017-1161-y.
- Imakaev Maxim, Fudenberg Geoffrey, McCord Rachel Patton, Naumova Natalia, Goloborodko Anton, Lajoie Bryan R, Dekker Job, Mirny Leonid A. Iterative correction of Hi-C data reveals hallmarks of chromosome organization (англ.) // Nature Methods. — 2012. — 2 September (vol. 9, no. 10). — P. 999—1003. — ISSN 1548-7091. — doi:10.1038/nmeth.2148.
- Lajoie Bryan R., Dekker Job, Kaplan Noam. The Hitchhiker’s guide to Hi-C analysis: Practical guidelines (англ.) // Methods. — 2015. — January (vol. 72). — P. 65—75. — ISSN 1046-2023. — doi:10.1016/j.ymeth.2014.10.031.
- Zambelli Federico, Pesole Graziano, Pavesi Giulio. Motif discovery and transcription factor binding sites before and after the next-generation sequencing era (англ.) // Briefings in Bioinformatics. — 2012. — 19 April (vol. 14, no. 2). — P. 225—237. — ISSN 1477-4054. — doi:10.1093/bib/bbs016.
- Wong Ka-Chun, Li Yue, Peng Chengbin. Identification of coupling DNA motif pairs on long-range chromatin interactions in human K562 cells (англ.) // Bioinformatics. — 2015. — 26 September (vol. 32, no. 3). — P. 321—324. — ISSN 1367-4803. — doi:10.1093/bioinformatics/btv555.
- Taberlay Phillippa C., Achinger-Kawecka Joanna, Lun Aaron T.L., Buske Fabian A., Sabir Kenneth, Gould Cathryn M., Zotenko Elena, Bert Saul A., Giles Katherine A., Bauer Denis C., Smyth Gordon K., Stirzaker Clare, O'Donoghue Sean I., Clark Susan J. Three-dimensional disorganization of the cancer genome occurs coincident with long-range genetic and epigenetic alterations (англ.) // Genome Research. — 2016. — 6 April (vol. 26, no. 6). — P. 719—731. — ISSN 1088-9051. — doi:10.1101/gr.201517.115.