Изотопы бора
Изото́пы бо́ра — разновидности атомов (и ядер) химического элемента бора, имеющие разное содержание нейтронов в ядре.
Все изотопы бора имеют 5 протонов в ядре.
Природный бор состоит из двух стабильных изотопов, — бора-10 с концентрацией около 20 ат.% и остальное — бора-11. Соотношение этих двух изотопов варьируется в различных природных источниках в результате естественных природных процессов обогащения тем или иным изотопом. Усреднённые по разным природным источникам бора концентрации бора−10 и бора-11 составляют 19,97 ат.% и 80,17 ат.% соответственно с вариацией в пределах 18,929—20,386 и 79,614—81,071 ат.% соответственно.
Все остальные изотопы бора радиоактивны, самый долгоживущий из них — бор-8 с периодом полураспада 770 мс.
Таблица изотопов бора
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[1] (а. е. м.) |
Период полураспада[2] (T1/2) |
Канал распада | Продукт распада | Спин и чётность ядра[2] |
Распространённость изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 7 B |
5 | 2 | 7,029 712 ± (27) | (570 ± (14))⋅10-24 с [801 ± (20) кэВ] |
p | 6 Be |
(3/2−) | ||
| 8 B |
5 | 3 | 8,0 246 073 ± (11) | 771,9 ± (9) мс | β+, α | 4 He |
2+ | ||
| 8m B |
10 624 ± (8) кэВ | 0+ | |||||||
| 9 B |
5 | 4 | 9,0 133 296 ± (10) | (800 ± (300))⋅10-21 с | p | 8 Be |
3/2− | ||
| 10 B |
5 | 5 | 10,012 936 862 ± (16) | стабилен | 3+ | [0,189, 0,204][3] | |||
| 11 B |
5 | 6 | 11,009 305 167 ± (13) | стабилен | 3/2− | [0,796, 0,811][3] | |||
| 11m B |
12 560 ± (9) кэВ | 1/2+, (3/2+) | |||||||
| 12 B |
5 | 7 | 12,0 143 526 ± (14) | 20,20 ± (2) мс | β− (99,40 ± (2)%) | 12 C |
1+ | ||
| β−, α (0,60 ± (2)%) | 8 Be | ||||||||
| 13 B |
5 | 8 | 13,0 177 800 ± (11) | 17,16 ± (18) мс | β− (99,734 ± (36)%) | 13 C |
3/2− | ||
| β−, n (0,266 ± (36)%) | 12 C | ||||||||
| 14 B |
5 | 9 | 14,025 404 ± (23) | 12,36 ± (29) мс | β− (93,96 ± (23)%) | 14 C |
2− | ||
| β−, n (6,04 ± (23)%) | 13 C | ||||||||
| 14m B |
17 065 ± (29) кэВ | (4,15 ± (1,90))⋅10-21 с | 0+ | ||||||
| 15 B |
5 | 10 | 15,031 087 ± (23) | 10,18 ± (35) мс | β−, n (> 98,7 ± (1,0)%) | 14 C |
3/2− | ||
| β− (< 1,3%) | 15 C | ||||||||
| β−, 2n (< 1,5%) | 13 C | ||||||||
| 16 B |
5 | 11 | 16,039 841 ± (26) | > 4,6⋅10-21 с | n | 15 B |
0− | ||
| 17 B |
5 | 12 | 17,04 693 ± (22) | 5,08 ± (5) мс | β−, n (63 ± (1)%) | 16 C |
(3/2−) | ||
| β− (21,1 ± (2,4)%) | 17 C | ||||||||
| β−, 2n (12 ± (2)%) | 15 C | ||||||||
| β−, 3n (3,5 ± (7)%) | 14 C | ||||||||
| β−, 4n (0,4 ± (3)%) | 13 C | ||||||||
| 18 B |
5 | 13 | 18,05 560 ± (22) | < 26 нс | n | 17 B |
(2−) | ||
| 19 B |
5 | 14 | 19,06 417 ± (56) | 2,92 ± (13) мс | β−, n (71 ± (9)%) | 18 C |
(3/2−) | ||
| β−, 2n (17 ± (5)%) | 17 C | ||||||||
| β−, 3n (< 9,1%) | 16 C | ||||||||
| β− (> 2,9%) | 19 C | ||||||||
| 20 B[4] |
5 | 15 | 20,07 451 ± (59) | > 912,4⋅10-24 с | n | 19 B |
(1−, 2−) | ||
| 21 B[4] |
5 | 16 | 21,08 415 ± (60) | > 760⋅10-24 с | 2n | 19 B |
(3/2−) | ||
Пояснения к таблице
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами 'm', 'n', 'p' (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Символами, выделенными жирным шрифтом, обозначены стабильные продукты распада. Символами, выделенными жирным курсивом, обозначены радиоактивные продукты распада, имеющие периоды полураспада, сравнимые с возрастом Земли или превосходящие его и вследствие этого присутствующие в природной смеси.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Применение
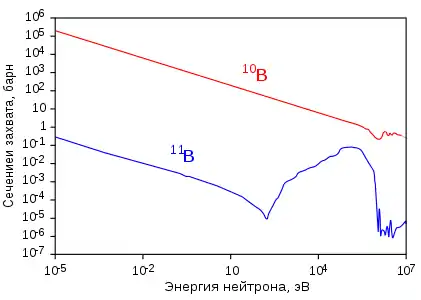
Бор-10 имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства изотопов других элементов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуется возбуждённое ядро бора-11 (11B*) сразу распадающееся на два стабильных ядра (альфа-частицу и ядро лития-7), эти ядра очень быстро тормозятся в среде, а проникающая радиация (гамма-излучение и нейтроны) при этом отсутствуют, в отличие от аналогичных реакций захвата нейтронов другими изотопами:
- + 2,31 МэВ.
Поэтому 10В в составе раствора борной кислоты и других химических соединений, например, карбида бора применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты персонала от тепловых нейтронов. Для повышения эффективности поглощения нейтронов бор, применяемый в реакторах, иногда специально обогащают изотопом бор-10.
Кроме того, соединения бора применяются в нейтрон-захватной терапии некоторых видов рака мозга, пробег ионизирующих быстрых ядер гелия-4 и лития-7 в тканях организма очень мал и поэтому при этом не поражаются ионизирующим излучением здоровые ткани.
Газообразное химическое соединение бора BF3 используется в качестве рабочей среды в ионизационных камерах детекторов тепловых нейтронов.
В 2015 году в опубликованной в журнале Science статье[5] было предложено применить измерение соотношения изотопов бора в древних осадочных породах позднего пермского периода и начала триасового периодов для определения изменения кислотности воды (pH) палеоокеанов в те эпохи, для объяснения возможных причин массового пермского вымирания в основном водных организмов, вызванное, вероятно, глобальным усилением вулканической деятельности, сопровождающейся выбросом углекислого газа в атмосферу. Этот метод определения кислотности древних океанов, по-видимому, более точен, чем ранее применявшийся метод определения кислотности по соотношению изотопов кальция[6] и изотопов углерода.
Примечания
- Данные приведены по Meng Wang, Huang W. J., Kondev F. G., Audi G., Naimi S. The Ame2020 atomic mass evaluation (II). Tables, graphs and references (англ.) // Chinese Physics C. — 2021. — Vol. 43, iss. 3. — P. 030003-1—030003-512. — doi:10.1088/1674-1137/abddaf.
- Данные приведены по Kondev F. G., Wang M., Huang W. J., Naimi S., Audi G. The Nubase2020 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2021. — Vol. 45, iss. 3. — P. 030001-1—030001-180. — doi:10.1088/1674-1137/abddae.

- Atomic Weight of Boron. CIAAW.
- Leblond, S.; et al. (2018). “First observation of 20B and 21B”. Physical Review Letters. 121 (26): 262502–1–262502–6. arXiv:1901.00455. DOI:10.1103/PhysRevLett.121.262502. PMID 30636115.
- Clarkson, M. O. et al. (2015) Science 348, 229—232.
- Witze, Alexandra (2015) Acidic oceans linked to greatest extinction ever; Rocks from 252 million years ago suggest that carbon dioxide from volcanoes made sea water lethal. Journal Nature; News publiée le 09 avril 2015