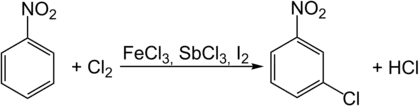3-Нитрохлорбензол
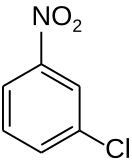
3-Нитрохлорбензо́л (мета-нитрохлорбензо́л, м-нитрохлорбензо́л, 3-НХБ) — органическое вещество с формулой C6H4ClNO2, образующее кристаллы светло-жёлтого цвета[1] .
| 3-Нитрохлорбензол | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
1-нитро-3-хлорбензол | ||
| Сокращения | 3-НХБ | ||
| Традиционные названия | мета-нитрохлорбензол | ||
| Хим. формула | C6H4ClNO2 | ||
| Физические свойства | |||
| Состояние | кристаллы светло-жёлтого цвета[1][2] | ||
| Молярная масса | 157,553 г/моль | ||
| Плотность | 1,534[3] | ||
| Поверхностное натяжение | 4,37·10-2 (при 44,5 °С)[4] Н/м | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 46[3] | ||
| • кипения | 236[3] °C | ||
| • вспышки | 127[5] °C | ||
| • самовоспламенения | 260[5] °C | ||
| Критическая точка | |||
| • температура | 468,85[4] °C | ||
| • давление | 39,28[4] | ||
| Удельная теплота испарения | 3,54·105 (при 44,5 °С)[4] | ||
| Давление пара | 0,097 мм рт. ст. (при 25 °С)[4] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,273[6] | ||
| Оптические свойства | |||
| Показатель преломления | 1,343 (при 50 °С)[1] | ||
| Классификация | |||
| Рег. номер CAS | 121-73-3 | ||
| PubChem | 8489 | ||
| Рег. номер EINECS | 204-496-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | CZ0940000 | ||
| ChEBI | 82420 | ||
| ChemSpider | 21106013 | ||
| Безопасность | |||
| Предельная концентрация | 0,001 мг/л[7] | ||
| ЛД50 | мыши: 380 мг/кг[8], крысы: 420 мг/кг[9] | ||
| Сигнальное слово | Опасно | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Является веществом второго класса опасности, ПДК в воздухе 1 мг/м3. Сильный гемо- и нейротоксин, по своей токсичности напоминает нитробензол[7].
Физические свойства
3-Нитрохлорбензол при нормальных условиях твёрдое кристаллическое вещество светло-жёлтого цвета. Практически нерастворим в воде, хорошо растворим в горячем этаноле, диэтиловом эфире, бензоле, хлороформе, ледяной уксусной кислоте[1], сероуглероде. Частично растворим в холодном этаноле[3].
Химические свойства
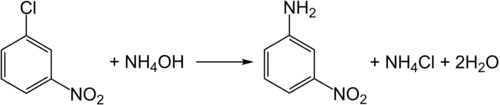
Вступает в реакцию аммонолиза, но в отличие от 2- и 4-нитрохлорбензолов требуются более жёсткие условия чем нагрев до 200 °С и давление 30-40 атм.[10]:
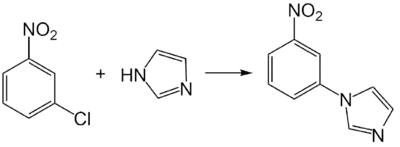
Вступает в реакцию нуклеофильного замещения с имидазолом, образуя 1-(3-нитрофенил)-1H-имидазол. Реакция протекает в ДМФА при 120 °С в присутствии карбоната калия и оксида меди (II)[11].
Определение
Существует способ определения 3-нитрохлорбензола в воздухе рабочей зоны при помощи газовой хроматографии[12].
Лабораторное получение
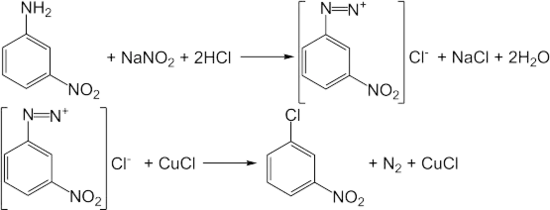
В лаборатории 3-нитрохлорбензол получают диазотированием 3-нитроанилина с последующим замещением диазониевой группы на атом хлора по реакции Зандмейера[1]:
Может быть получен с выходом 92% дезаминированием 4-нитро-2-хлоранилина в ТГФ под действием трет-бутилнитрита и ДМСО при температуре 30 °С в течение 1 часа[13].
Промышленное производство
При нитровании хлорбензола образуются следовые количества 3-нитрохлорбензола, поэтому в отличие от 2- и 4-нитрохлорбензола получать его таким способом нерентабельно[14]. Для получения 3-нитрохлорбензола в промышленности применяют каталитическое хлорирование нитробензола при нагревании, в качестве катализатора может применяться FeCl3, SbCl3 или I2. Помимо целевого продукта также образуются изомеры 3-нитрохлорбензола и динитрохлорбензолы, которые отделяют ректификацией[15]:
Применение
3-Нитрохлорбензол применяется главным образом для синтеза 3-нитроанилина, применяемого в холодном крашении[15], а также 3-фенилендиамина, являющегося полупродуктом в производстве красителей, медицинских препаратов и стабилизаторов полимеров[16].
Токсичность
3-Нитрохлорбензол — сильный гемо- и нейротоксин[7][17]. По своему токсическому действию похож на нитробензол, в том числе, например, может вызывать токсидермию[17][18]. При вдыхании или проглатывании возникают следующие симптомы: посинение губ, ногтей и кожи, головная боль, головокружение, тошнота, судороги, спутанное сознание. При попадании в глаза вызывает покраснение. Может впитываться через кожу[19].
Достоверных данных о канцерогенности 3-нитрохлорбензола не обнаружено[20].
Примечания
- О. А. Птицина. Лабораторные работы по органическому синтезу: учебное пособие для химических и биологических специальностей педагогических институтов / Редактор Т. В. Александрова. — М.: Просвещение, 1979. — С. 161—162. — 256 с. — 21 000 экз.
- 3-CHLORONITROBENZENE CAMEO Chemicals NOAA< (англ.). Дата обращения: 30 сентября 2017. Архивировано 15 июля 2021 года.
- O'Neil, M.J. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. 13th Edition, Whitehouse Station, NJ: Merck and Co., Inc., 2001., p. 370
- T. E. Daubert, R. P. Danner. Physical and Thermodynamic Properties of Pure Chemicals Data Compilation. — Washington, D.C.: Taylor and Francis, 1989.
- Fire Protection Guide to Hazardous Materials. — 13th Edition. — Quincy, MA: National Fire Protection Association, 2002. — С. 325.
- S. H. Yalkowsky, Y. He. Handbook of Aqueous Solubility Data: An Extensive Compilation of Aqueous Solubility Data for Organic Compounds Extracted from the AQUASOL dATAbASE. — Version 5. — Boca Raton, FL: CRC Press LLC, 2003. — С. 205.
- З. Э. Григорьев. Органическая химия: Учебник для вузов: в 2-х томах / Зав. редакцией М. Р. Погосбекова. — М.: Академкнига, 2004. — Т. 2. — С. 560—561. — 582 с. — 5000 экз. — ISBN 5-94628-068-6, 5-94628-172-0.
- Gigiena Truda i Professional'nye Zabolevaniya. Labor Hygiene and Occupational Diseases. Vol. 25(8), Pg. 50, 1981
- "Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure," Izmerov, N.F., et al., Moscow, Centre of International Projects, GKNT, 1982Vol. -, Pg. 92, 1982
- Л. С. Эфрос. Химия и технология ароматических соединений задачах и упражнениях / Редактор докт. хим. наук проф. Л. А. Павлова. — Л.: Химия, 1971. — С. 179—180, 188—189. — 496 с. — 7000 экз.
- M. Lakshmi Kantam, Jagjit Yadav, Soumi Laha, Bojja Sreedhar, Shailendra Jha. N-Arylation of Heterocycles with Activated Chloro- and Fluoroarenes using Nanocrystalline Copper(II) Oxide // Advanced Synthesis & Catalysis. — 2007-08-06. — Т. 349, вып. 11-12. — С. 1938–1942. — ISSN 1615-4169 1615-4150, 1615-4169. — doi:10.1002/adsc.200600483.
- Kolievskaya Y. A., Ivanyuk E. G.; DETERMINATION OF NITROCHLOROBENZENE IN THE WORK AREA AIR BY GAS CHROMATOGRAPHY; GIG TR PROF ZABOL (12) 54-6 (1975)
- Lu Fang, Liang Qi, Longfei Ye, Zhentao Pan, Wenjun Luo. Dimethyl Sulfoxide-Accelerated Reductive Deamination of Aromatic Amines with T-BuONO in Tetrahydrofuran // Journal of Chemical Research. — 2018-11. — Т. 42, вып. 11. — С. 579–583. — ISSN 2047-6507 1747-5198, 2047-6507. — doi:10.3184/174751918x15402967122774.
- И. И. Воронцов. Полупродукты анилинокрасочной промышленности. — М.: Государственное научно-техническое издательство химической литературы, 1955. — С. 330—332, 408. — 579 с.
- Л. С. Эфрос, М. В. Горелик. Химия и технология промежуточных продуктов. — Л.: Химия, 1980. — С. 182. — 544 с. — 3700 экз.
- Патент на изобретение № RU 2012144566 A от 27.12.2013. Автор(ы): Сергей Александрович Приходько, Антон Юрьевич Шабалин, Николай Юрьевич Адонин, Зинаида Петровна Пай, Александр Моисеевич Бескопыльный, Дарья Павловна Тучапская, Валентин Николаевич Пармон
- Вредные вещества в промышленности. том 2, 1976, с. 264.
- З. Э. Григорьев. Справочник профпатолога. — Л.: Медицина, 1967. — С. 54. — 420 с.
- ICSC: 0028 1-CHLORO-3-NITROBENZENE (англ.). Дата обращения: 30 сентября 2017.
- IARC. Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. Geneva: World Health Organization, International Agency for Research on Cancer, 1972—PRESENT. (Multivolume work). Available at: http://monographs.iarc.fr/ENG/Classification/index.php Архивная копия от 25 июня 2018 на Wayback Machine , p. 65 290 (1996)