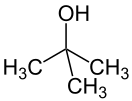
2-Метилпропанол-2
2-Метил-2-пропанол (трет-бутиловый спирт, трет-бутанол, триметилкарбинол, 1,1-диметилэтанол) — представитель третичных одноатомных спиртов.
| 2-Метилпропанол-2 | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-метил-2-пропанол | ||
| Традиционные названия | трет-бутиловый спирт, трет-бутанол | ||
| Хим. формула | C4H10O | ||
| Рац. формула | (CH3)3COH | ||
| Физические свойства | |||
| Состояние | бесцветные ромбические кристаллы | ||
| Молярная масса | 74,12 г/моль | ||
| Плотность | 0,7887 г/см³ | ||
| Энергия ионизации | 9,7 ± 0,1 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 25,5 °C | ||
| • кипения | 82,2 °C | ||
| • разложения | 500 °C | ||
| • вспышки | 10 °C | ||
| • самовоспламенения | 480 °C | ||
| Пределы взрываемости | 1,8-8,0 % | ||
| Энтальпия | |||
| • кипения | 39,07 кДж/моль[2] | ||
| Удельная теплота испарения | 535 400 Дж/кг | ||
| Давление пара | 42 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 17[3] | ||
| Оптические свойства | |||
| Показатель преломления | 1,3974 | ||
| Классификация | |||
| Рег. номер CAS | 75-65-0 | ||
| PubChem | 6386 | ||
| Рег. номер EINECS | 200-889-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | EO1925000 | ||
| ChEBI | 45895 | ||
| Номер ООН | 1120 | ||
| ChemSpider | 6146 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
Реакция изобутилена с серной кислотой с последующим гидролизом.
Физические свойства
Бесцветные легкоплавкие кристаллы. Смешивается с водой, дает с ней азеотропную смесь (т. кип. 79,9° C, 11,8 % воды). Хорошо растворим в органических растворителях.
Химические свойства
Типичный представитель спиртов. Спокойно реагирует с щелочными металлами. С карбоновыми кислотами дает сложные эфиры.
Применение
В производстве изобутилена высокой чистоты. Алкилирующий агент, растворитель, антисептик. Душистое вещество в парфюмерии (камфорный запах). Используется для денатурации спирта. Tрет- Бутанол используется в качестве присадки к топливу для предотвращения обледенения карбюратора или в качестве антидетонационного агента. Кроме того, спирт используют в качестве исходного материала для синтеза трет бутиловых эфиров.
Примечания
Литература
- «Свойства органических соединений: Справочник». — Под ред. Потехина А. А. — Л.: Химия, 1984. — С. 320—321
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977. — С. 134
- Реутов О. А., Курц А. Л., Бутин К. П. «Органическая химия». — 2-е изд., Ч.1. — М.: Бином. Лаборатория знаний, 2005. — С. 222
- Хёрд Ч. Д. «Пиролиз соединений углерода». — Л.-М.: ГОНТИ РКТП СССР, 1938. — С. 155
- «Химический энциклопедический словарь». — Под ред. Кнунянц И. Л. — М.: Советская энциклопедия, 1983. — С. 88
- «Химическая энциклопедия». — Т.1. — М.: Советская энциклопедия, 1992. — С. 57-58