Трифторуксусная кислота
Трифтору́ксусная кислота́ (трифторэтановая кислота) — фторорганическая карбоновая кислота, органическое вещество. По внешнему виду представляет собой бесцветную дымящую жидкость с резким специфическим запахом (отдалённо напоминающим запах уксусной кислоты). Смешивается во всех отношениях с водой, этанолом, ацетоном, диэтиловым эфиром. С водой образует азеотроп (20,6 % воды).
| Трифторуксусная кислота | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
трифторэтановая кислота |
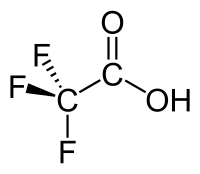
| Хим. формула | CF3COOH |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 114,03 г/моль |
| Плотность | 1,531 г/см³ |
| Поверхностное натяжение | 13,53 ± 0,01 мН/м[1] и 11,42 ± 0,01 мН/м[1] |
| Динамическая вязкость | 0,808 ± 0,001 мПа·с[2] и 0,571 ± 0,001 мПа·с[2] |
| Термические свойства | |
| Температура | |
| • плавления | -15,36 °C |
| • кипения | 72,4 °C |
| Критическая точка | 218,15 |
| Давление пара | 10 ± 1 кПа[3], 15,1 ± 0,1 кПа[4] и 100 ± 1 кПа[3] |
| Химические свойства | |
| Константа диссоциации кислоты | 0,23 |
| Растворимость | |
| • в воде | смешивается |
| Структура | |
| Дипольный момент | 2,28 ± 0,25 Д[5] |
| Классификация | |
| Рег. номер CAS | 76-05-1 |
| PubChem | 6422 |
| Рег. номер EINECS | 200-929-3 |
| SMILES | |
| InChI | |
| RTECS | AJ9625000 |
| ChEBI | 45892 |
| ChemSpider | 10239201 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Электрохимическим фторированием уксусного ангидрида или фторангидрида в безводном HF.
Кислотным гидролизом 1,1,1-трифтор-2,2,2-трихлорэтана.
Окисление 2,2,2-трифторэтанола.
Химические свойства
Сильная одноосновная кислота. Разрушает металлы, пробку, резину, бакелит, полиэтилен. Не действует на фторопласт и сухое стекло. Термически стабильна, не разлагается при нагревании до 400 С.
С диалкиловыми эфирами, кетонами, карбоновыми кислотами и другими электронодонорными соединениями даёт прочные комплексы.
Легко присоединяется по кратным связям алкенов, циклоалкенов, ацетиленов с образованием трифторацетатов. С галогенами даёт малоустойчивые гипогалогениты, которые селективно галогенируют различные соединения. Реакция с многоатомными спиртами (например, с триолами) приводит к полициклическим ортоэфирам.
При действии оксида фосфора(V) на трифторуксусную кислоту образуется ангидрид трифторуксусной кислоты — сильный ацилирующий агент. Реакция трифторуксусной кислоты со спиртами даёт эфиры, с аминами — амиды.
Примечания
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—182. — ISBN 978-1-4822-0868-9
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—231. — ISBN 978-1-4822-0868-9
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—95. — ISBN 978-1-4822-0868-9
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15—21. — ISBN 978-1-4822-0868-9
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 9—59. — ISBN 978-1-4822-0868-9
Литература
- «Краткая химическая энциклопедия». — т.5, Т-Я. — М.: Советская энциклопедия, 1967. — С. 276
- «Промышленные фторорганические продукты: Справочник». — Л.: Химия, 1990. — С. 367—371
- «Справочник химика». — Т.3. — М.-Л.: Химия, 1965. — С. 118
- «Химическая энциклопедия». — Т.5. — М.: Советская энциклопедия, 1999. — С. 9
- Альберт А., Сержент Е. «Константы ионизации кислот и оснований». — М.-Л.: Химия, 1964. — С. 118
- Гудлицкий М. «Химия органических соединений фтора». — М.: ГНТИХЛ, 1961. — С. 270
- Некрасов Б. В. «Основы общей химии». — Т.1. — М.: Химия, 1973. — С. 563—564
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977. — С. 184
