Себациновая кислота
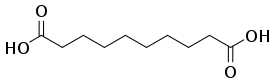
Себаци́новая кислота (декандиовая кислота) НООС(СН2)8СООН — двухосновная предельная карбоновая кислота (лат. sebaceus — свечное масло, сало). Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры себациновой кислоты называются себацинатами.
| Себациновая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
декандиовая кислота, 1,8-октандикарбоновая кислота |
| Традиционные названия | себациновая кислота |
| Хим. формула | C10H18O4 |
| Рац. формула | HO2C(CH2)8CO2H |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 202,25 г/моль |
| Плотность | 1,209 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 134—135 °C |
| • кипения | (при 10 мм рт. ст.) 232 °C |
| • разложения | 280—300 °C |
| • самовоспламенения | 332 °C |
| Энтальпия | |
| • сгорания | −5409,4 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты | K1 2,38⋅10−5; K2 0,26⋅10−5 |
| Растворимость | |
| • в воде |
0,1 г/100 г (15 °C); 2 г/100 г (100 °C) |
| Структура | |
| Дипольный момент | 8,3⋅10−30 Кл·м |
| Классификация | |
| Рег. номер CAS | 111-20-6 |
| PubChem | 5192 |
| Рег. номер EINECS | 203-845-5 |
| SMILES | |
| InChI | |
| RTECS | VS0875000 |
| ChEBI | 41865 |
| ChemSpider | 5004 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Впервые получена в 1802 г. Тенаром при сухой перегонке свиного жира.
В промышленности себациновую кислоту получают в основном из касторового масла. При его нагревании с водой (200—225 °С; 1,8-2,5 МПа) образуется глицерин и смесь карбоновых кислот, содержащая 80-85 % рицинолевой кислоты; разложение последней щёлочью при 250 °C с последующим омылением образующегося себацината натрия минеральными кислотами приводит к выделению себациновой кислоты (выход — 35-40 % в расчёте на касторовое масло).
Перспективный метод получения себациновой кислоты — анодная конденсация монометиладипината до диметилсебацината с последующим гидролизом диэфира:

Процесс проводят в метаноле на электродах из платинированного титана при плотности тока 600—1500 А/м², температуре 45-55 °C, гидролиз диэфира осуществляется в избытке воды (220—240 °C; 3,9-4,9 МПа); выход себациновой кислоты в таком случае составляет 70-75 %.
Себациновую кислоту можно также получить окислением циклодекана HNO3 или из 1,3-бутадиена и этилена по схеме:
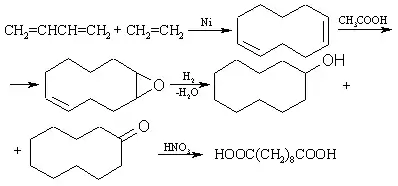
Свойства
При восстановлении себациновой кислоты образуется 1,10-декандиол; при действии Br2 на себацинат серебра — 1,8-дибромоктан; при дегидратации аммониевой соли или диамида — себацинодинитрил. Нагревание себациновой кислоты с уксусным ангидридом приводит к образованию неустойчивого полимерного ангидрида, который отщепляет CO2 и превращается в циклононанон.
Себациновая кислота способна к поликонденсации с бифункциональными соединениями: с гликолями образует полиэфиры [-OROCO(CH2)8CO-]n; с диаминами и аминоспиртами — соответствующие полиамиды и полиэфироамиды [-XRNHCO(CH2)8CO-]n (X = O, NH).
Температура декарбоксилирования 350—370 °C.
Энтальпия сгорания (ΔH0сгор) −5409,4 кДж/моль.
Применение
Себациновую кислоту применяют в промышленности для производства полигексаметиленсебацинамида (найлон-1,6), полиэфирных волокон и клеев, в качестве стабилизатора алкидных смол. Используется при производстве гидравлических жидкостей, в косметике, свечах и др. Также является промежуточным звеном в производстве антисептиков. Из эфиров себациновой кислоты применяют дибутил- и диоктилсебацинаты в качестве пластификаторов ПВХ, диизобутилсебацинат — пластификата ряда эластомеров. Бис(2-этилгексил)себацинат входит в состав масел и смазок, применяемых при низких температурах.
Эфиры себациновой кислоты — горючие малотоксичные вещества; для дибутилсебацината ЛД50 25,5 г/кг; для диоктилсебацината — 19,6 г/кг, ПДК — 10 мг/м³.
Общемировая мощность действующих линий по выработке этого вещества и его производных на сегодняшний день приближается к 170 тыс. тонн в год[1].
Литература
- Кларе Г., Фрицше Э., Гребе Ф., Синтетические полиамидные волокна, пер. с нем., М., 1966.
- Фрейдлин Г.Н., Алифатические дикарбоновые кислоты, М., 1978. С. К. Смирнов.
- Алифатические дикарбоновые кислоты, М., 1978. С. К. Смирнов.
