о-Фенилендиамин
о-Фенилендиамин — органическое соединение с формулой C6H8N2, ароматический диамин.
| о-Фенилендиамин[1][2] | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
1,2-диаминобензол, 1,2-фенилендиамин | ||
| Сокращения | OPD | ||
| Хим. формула | C6H8N2 | ||
| Рац. формула | C6H4(NH2)2 | ||
| Физические свойства | |||
| Молярная масса | 108,14 г/моль | ||
| Энергия ионизации | 690 кДж/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 103 °C | ||
| • кипения | 257 °C | ||
| Классификация | |||
| Рег. номер CAS | 95-54-5 | ||
| PubChem | 24898319 | ||
| Рег. номер EINECS | 202-430-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 34043 | ||
| ChemSpider | 13837582 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³ | ||
| ЛД50 | 80-90 мг/кг | ||
| Фразы риска (R) | R23/24/25, R36, R43, R50/53, R68 | ||
| Фразы безопасности (S) | S28, S36/37, S45, S60, S61 | ||
| Краткие характер. опасности (H) |
H301, H312+H332, H317, H319, H341, H351, H371, H410 |
||
| Меры предостор. (P) |
P260, P273, P280, P301+P310, P305+P351+P338, P501 |
||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение и лабораторная очистка
В промышленности о-фенилендиамин получают восстановлением 2-нитроанилина, который синтезируют аминированием 2-нитрохлорбензола. Восстановление можно проводить под действием различных реагентов, например, порошка железа, гидразина или сероводорода. Промышленный метод предполагает использование палладиевого катализатора. Также о-фенилендиамин можно получать аминированием 1,2-дихлорбензола или аминированием анилина[3].
В лаборатории о-фенилендиамин очищают кристаллизацией из 1 % водного раствора гидросульфита натрия, после чего вещество промывают ледяной водой, сушат в вакууме и сублимируют в вакууме. Возможна также очистка кристаллизацией из толуола и зонной плавкой. Можно также кипятить раствор диамина в хлористом метилене с углём, затем его упарить, а остаток перекристаллизовать[4].
Химические свойства
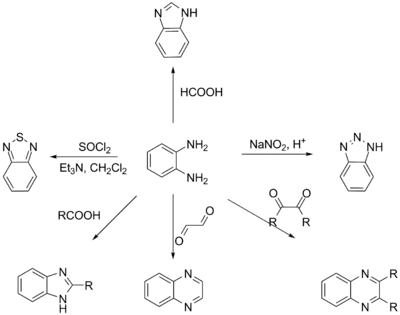
о-Фенилендиамин проявляет свойства типичного ароматического амина, выступая в реакциях как основание и образуя устойчивые соли. Ароматическое кольцо может быть гидрировано с образованием дизамещённого циклогексана. При реакции с муравьиной кислотой происходит циклизация и образуется бензимидазол. Реакция с нитрилами или альдегидами в присутствии ацетата меди(II) приводит в алкилзамещённым бензимидазолам. о-Фенилендиамин можно вводить в реакции с 1,2-дикарбонильными соединениями: при этом получаются хиноксалины. При реакции с азотистой кислотой в разбавленной серной кислоте происходит образование бензотриазола[3].
о-Фенилендиамин вступает в ряд окислительных реакций. Так, при его окислении водным хлоридом железа(III) образуется 2,3-диаминофеназин. Окисление оксидом серебра даёт о-бензохинондиимин, а окисление на воздухе в присутствии хлорида меди(I) приводит к образованию 1,4-дициано-1,3-бутадиена[3].
Применение
Значительная часть о-фенилендиамина расходуется на синтез фунгицидов, содержащих в своей структуре фрагмент бензимидазола. Также о-фенилендиамин находит применение в синтезе ветеринарных антигельминтных препаратов[3].
Токсичность
о-Фенилендиамин вызывает кожную сыпь, а также, вероятно, проникает через кожу в токсичных количествах. Испытания на кроликах показали, что данное вещество вызывает у них снижение веса, потерю координации, слабость, потемнение мочи и смерть. о-Фенилендиамин не считается канцерогеном, но провоцирует ненаследуемый генетический ущерб в клеточных культурах бактерий и млекопитающих[3].
Примечания
- Sigma-Aldrich. o-Phenylenediamine. Дата обращения: 9 января 2014.
- Dean J. A. Lange's Handbook of Chemistry. — McGraw-Hill, 1999. — ISBN 0-07-016384-7.
- Smiley R. A. Phenylene- and Toluenediamines // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley. — 2000. — doi:10.1002/14356007.a19_405.
- Amarego W. L. F., Chai C. L. L. Purification of Laboratory Chemicals. — Sixth ed. — Elsevier, 2009. — P. 329. — ISBN 978-1-85617-567-8.
Ссылки
- Sigma-Aldrich. ЯМР-спектр о-фенилендиамина. Дата обращения: 9 января 2014.
- Sigma-Aldrich. ИК-спектр о-фенилендиамина. Дата обращения: 9 января 2014.
- Sigma-Aldrich. КР-спектр о-фенилендиамина. Дата обращения: 9 января 2014.