Гидросульфит натрия
Гидросульфи́т на́трия или бисульфи́т на́трия — химическое соединение, кислая соль натрия и сернистой кислоты с химической формулой NaHSO3. Антиоксидант и консервант (E222). Не следует путать с дитионитом натрия, которого в зарубежной литературе называют sodium hydrosulfite.
| Гидросульфит натрия | |
|---|---|
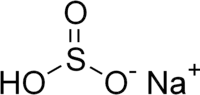 | |
| Общие | |
| Систематическое наименование |
Гидросульфит натрия |
| Сокращения | консервант E222 |
| Хим. формула | NaHSO3 |
| Физические свойства | |
| Состояние | Бесцветное кристаллическое вещество с сероватым оттенком |
| Молярная масса | 104.061 г/моль |
| Плотность | 1.48 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 150 °C |
| • вспышки | негорюч °C |
| Химические свойства | |
| Растворимость | |
| • в воде | хорошо растворим в воде 39.77(22.8°C), 49.06(97.2°C) |
| Классификация | |
| Рег. номер CAS | 7631-90-5 |
| PubChem | 656672 |
| Рег. номер EINECS | 231-548-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E222 |
| RTECS | VZ2000000 |
| ChEBI | 26709 |
| ChemSpider | 571016 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
- Обладает отбеливающими свойствами; хорошо растворим в воде.
- Взаимодействует с хлоратом калия (автокатализ) с бурным выделением сернистого газа[1][2] при большом избытке гидросульфита:
Получение
- (разб.)
- (гр.)
- (разб.), при комнатной температуре
- (гор.)
- (разб.)
Применение
Гидросульфит натрия применяют в легкой, химической и других отраслях промышленности. В пищевой промышленности применяется как консервант или антиокислитель.
Гидросульфит натрия используется почти во всех идущих на экспорт винах для предотвращения окисления и сохранения вкуса. При консервировании фруктов применяется для предотвращения потемнения и для борьбы с микробами. В очень больших концентрациях может вызывать серьёзные аллергические реакции.
Используется как консервирующее средство, при белении и крашении тканей. При крашении натуральным индиго гидросульфит натрия используется как восстановитель для перевода его так называемый лейкоиндиго (восстановленную растворимую форму); после вымачивания ткани в растворе лейкоиндиго и дальнейшей сушки на воздухе под действием кислорода она приобретает синий цвет (лейкоиндиго окисляется до синего индиго).
С 1980-х годов гидросульфит натрия запрещён в США к использованию на сырых овощах и фруктах после серии летальных исходов.[3] Вызывает заболевания желудочно-кишечного тракта.
См. также
- Тетраалкиаммониевые соли (формула NR4HSO3)
Примечания
- Выделение газа — признак химической реакции (взаимодействие хлората калия с гидросульфитом натрия) Архивная копия от 4 марта 2016 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- Иванова М. А., Кононова М. А. Опыт 90. Автокатализ. Взаимодействие хлората калия с раствором бисульфита натрия. // Химический демонстрационный эксперимент. Под ред. С. А. Щукарева. Руководство для ассистентов и лаборантов вузов. — М.: Высшая школа, 1969. — С. 67. — 248 с.
- van der Leun, Justine What's In Your Food?. AOL Health (July 2009). Дата обращения: 1 августа 2009. Архивировано 19 апреля 2012 года.
