Островной гигантизм
Островной гигантизм — биологический феномен, явление, при котором величина отдельных видов животных, обитающих на изолированном острове, крайне быстро увеличивается с каждым последующим поколением.[1] Островной гигантизм — один из аспектов более общего «эффекта острова» или «правила Фостера», согласно которому, когда материковые животные колонизируют острова, мелкие виды имеют тенденцию эволюционировать в более крупные тела, а крупные виды имеют тенденцию эволюционировать в более мелкие тела (островная карликовость). После прибытия людей и связанных с ними интродуцированных хищников (собак, кошек, крыс, свиней) многие гигантские, а также другие островные эндемики вымерли. Аналогичное увеличение размеров, а также повышенное одревеснение наблюдалось у некоторых островных растений.

Возможные причины

Крупные плотоядные млекопитающие часто отсутствуют на островах из-за недостаточного ареала обитания или трудностей в расселении по воде. В их отсутствие экологические ниши для крупных хищников могут быть заняты птицами, рептилиями или мелкими хищниками, которые затем могут вырасти до размеров, превышающих нормальные. Например, на доисторическом острове Гаргано в миоцен-плиоценовом Средиземноморье, на островах Карибского моря, таких как Куба, а также на Мадагаскаре и Новой Зеландии, некоторые или все высшие хищники были такими птицами, как орлы, соколы и совы, включая некоторые из самых крупных известных примеров этих групп. Однако птицы и рептилии обычно являются менее эффективными крупными хищниками, чем продвинутые хищники.
Поскольку небольшой размер обычно помогает травоядным животным сбежать или спрятаться от хищников, уменьшение давления хищников на острова может позволить им вырасти в размерах.[2][lower-alpha 1] Мелкие травоядные также могут извлечь выгоду из отсутствия конкуренции со стороны отсутствующих видов крупных травоядных.
Преимущества больших размеров, которые были предложены для островных черепах, включают в себя снижение уязвимости для дефицита пищи или воды, благодаря способности выживать в течение более длительных промежутков времени без них или способности преодолевать большие расстояния, чтобы получить их. Периоды такой нехватки могут быть более опасными на океанских островах, чем на материке.[5]
Таким образом, островной гигантизм обычно представляет собой эволюционную тенденцию, возникающую в результате устранения ограничений на размер мелких животных, связанных с хищничеством и / или конкуренцией.[6] Однако такие ограничения могут действовать по-разному в зависимости от размера животного; например, в то время как мелкие травоядные животные могут избежать хищников, скрывшись, крупные травоядные могут отпугивать хищников устрашением. В результате дополнительный феномен островной карликовости может также возникнуть в результате устранения ограничений, связанных с хищничеством и / или конкуренцией в отношении размеров крупных травоядных.[1] В отличие от этого, островная карликовость среди хищников чаще всего является результатом введения ограничений, связанных с ограниченными ресурсами добычи, доступными на островах.[1] В отличие от островной карликовости, островной гигантизм встречается в большинстве основных групп позвоночных и беспозвоночных.
Территориализм может способствовать развитию островного гигантизма. Исследование, проведенное на острове Анахо в штате Невада, показало, что виды рептилий, которые были территориальными, как правило, были больше на острове по сравнению с материком, особенно у более мелких видов. У территориальных видов больший размер делает особей более способными конкурировать за защиту своей территории. Это дает дополнительный импульс эволюции к увеличению размеров островной популяции.[7]
Еще одним средством установления островного гигантизма может быть эффект основателя, действующий тогда, когда более крупные члены материковой популяции превосходят их в способности колонизировать острова.[8]
Размер острова играет определенную роль в определении степени гигантизма. Более мелкие острова, как правило, ускоряют скорость эволюции изменений размеров организмов, а организмы на них развиваются в больших размерах.[9]
Примеры
Примеры островного гигантизма включают:
Млекопитающие
Многие грызуны вырастают крупнее на островах, в то время как хищники, парнокопытные и хоботные обычно становятся меньше.
Насекомоядные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Корсиканская гигантская землеройка | Asoriculus corsicanus | Корсика | Вымер (до 500 года до н. э.) |  Бурозубки |
| Балеарская гигантская землеройка | Asoriculus hidalgo | Мальорка и Менорка | Вымер | |
| Сардинская гигантская землеройка | Asoriculus similis | Сардиния | Вымер | |
 Deinogalerix | Deinogalerix spp. | Гаргано | Вымер (Поздний миоцен) |  Гимнуры |
Грызуны
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник | Островное / материковое соотношение длины и массы |
|---|---|---|---|---|---|
| Amblyrhiza inundata | Amblyrhiza inundata | Ангилья и Сен-Мартен | Вымер (Плейстоцен) |  Щетинистые крысы | |
| Clidomys osborni | Clidomys osborni | Ямайка | Вымер (Поздний плейстоцен) | ||
| Elasmodontomys obliquus | Elasmodontomys obliquus | Пуэрто-Рико | Вымер (около 1 года нашей эры) | ||
| Quemisia gravis | Quemisia gravis | Гаити | Вымер | ||
| Tainotherium valei[10] | Tainotherium valei | Пуэрто-Рико | Вымер | ||
| Xaymaca fulvopulvis | Xaymaca fulvopulvis | Ямайка | Вымер | ||
| Майоркские гигантские хомяки | Apocricetus darderi Tragomys macpheei | Мальорка | Вымер | Apocricetus alberti[11] Cricetus kormosi[12] | |
 Гарганский гигантский хомяк | Hattomys gargantua | Гаргано | Вымер | ||
.png.webp) Сент-килдская полевая мышь | Apodemus sylvaticus hirtensis | Сент-Килда | Виды под наименьшей угрозой |  Европейская мышь | MR ≈ 2[13] |
 Rhagamys orthodon | Rhagamys orthodon | Корсика и Сардиния | Вымер (Поздний плейстоцен) | ||
 Гигантская крыса Тенерифе | Canariomys bravoi | Тенерифе | Вымер (Поздний плейстоцен) | Ржавоносые крысы | |
 Гигантская крыса Гран-Канарии | Canariomys tamarani | Гран-Канария | Вымер (до 1500 года н. э.) | ||
| Форментерская чернохвостая садовая соня | Eliomys quercinus ophiusae | Форментера | Редкий[14] |  Садовая соня и другие сони | |
| Менорская гигантская соня | Hypnomys mahonensis | Менорка | Вымер | ||
 Майоркская гигантская соня | Hypnomys morpheus | Мальорка | Вымер | ||
| Сицилийская гигантская соня | Leithia cartei | Сицилия | Вымер | ||
| Мальтийская гигантская соня | Leithia melitensis | Мальта | Вымер | ||
 Оркнейская полёвка | Microtus arvalis orcadensis | Оркнейские острова | Уязвимый |  Обыкновенная полёвка и другие луговые полевки | |
 Гигантская полёвка Гаргано | Mikrotia magna M. maiuscula M. parva | Гаргано | Вымер (Ранний плиоцен) | ||
 Сент-килдская домовая мышь | Mus musculus muralis | Сент-Килда | Вымер (около 1930) |  Домовая мышь | |
Флоресская крыса | Papagomys armandvillei | Флорес | Под угрозой |  Северо-африканская чёрная крыса и другие настоящие крысы | |
| Сулавеская гигантская крыса | Paruromys dominator | Сулавеси | Виды под наименьшей угрозой | ||
| Rattus detentus | Rattus detentus | Манус | Неизвестно / Вероятно, под угрозой[15] | ||
| Популяция чёрных крыс Конгресо[16] | Rattus rattus | Остров Конгресо | Виды под наименьшей угрозой | ||
| Оленьи хомячки островов Чаннел | Peromyscus anyapahensis P. nesodytes | Чаннел | Вымер (около 6000 г. до н. э.) |  Олений хомячок | |
 Гигантские сони Гаргано | Stertomys laticrestatus[17] | Гаргано | Вымер |  Сони |
Зайцеобразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Нуралагус | Nuralagus rex | Менорка | Вымер (Средний плиоцен) | Alilepus (?) Trischizolagus (?) |
| Prolagus imperialis | Prolagus imperialis | Гаргано | Вымер |  Пищухи |
 Сардинская пищуха | Prolagus sardus | Корсика, Сардиния и Таволара | Вымер (около 1800) |
Приматы
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Antillothrix bernensis | Antillothrix bernensis | Гаити | Вымер (до 1600 г.) |  Cheracebus |
| Гаитянская обезьяна | Insulacebus toussaintiana | Юго-западное Гаити | Вымер | |
 Paralouatta marianae | Paralouatta marianae[18] P. varonai[18] | Куба | Вымер (Плейстоцен) | |
| Xenothrix mcgregori | Xenothrix mcgregori | Ямайка | Вымер | |
 Археоиндри | Archaeoindris fontoynontii | Центральный Мадагаскар | Вымер (около 350 г. до н. э.) |  Лори |
 Археолемуры | Archaeolemur spp. Гадропитеки spp. | Мадагаскар | Вымер (до 1280 г.) | |
 Палеопропитековые | Бабакотии spp. Палеопропитеки spp. | Западный и Центральный Мадагаскар | Вымер (около 1500 г.) | |
 Мегаладаписы | Megaladapis edwardsi M. grandidieri M. madagascariensis | Мадагаскар | Вымер (около 1280—1420 гг.) |
Хищники
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Сардинская гигантская выдра | Megalenhydris barbaricina | Сардиния | Вымер (Поздний плейстоцен) |  Выдры |
 Фосса | Cryptoprocta ferox | Мадагаскар | Уязвим |  Мангусты |
 Гигантская фосса | Cryptoprocta spelaea | Мадагаскар | Вымер (около 1400 г.) |
Примитивные птицы
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Balaur | Balaur bondoc | Остров Hateg | Вымер (Верхний мел) |  Джехолорнисы[19] |
 Gargantuavis philohinos | Gargantuavis philohinos | Пиренейско-арморийский остров | Вымер (Верхний мел) |  Patagopteryx (?) |
Бескилевые
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Киви | Apteryx spp. | Новая Зеландия | Различный | Proapteryx[lower-alpha 2] |
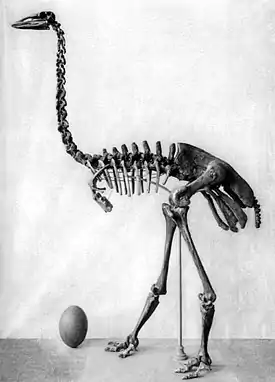 Большие птицы-слоны | Aepyornis hildebrandti A. maximus Vorombe titan | Мадагаскар | Вымер (около 1000 г. н. э.) | |
 Малые птицы-слоны | Mullerornis spp. | Мадагаскар | Вымер (около 1260 г. н. э.) | |
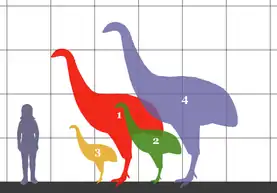 Моа | Anomalopteryx didiformis Dinornis spp. Emeus crassus Euryapteryx spp. Megalapteryx didinus Pachyornis spp. | Новая Зеландия | Вымер (до 1445 года н. э.) |  Тинаму |
Гусеобразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Новозеландская лопастная утка | Biziura delautouri | Новая Зеландия | Вымер (после 1500 г.) |  Австралийская лопастная утка |
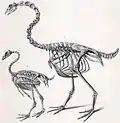 Новозеландские гуси | Cnemiornis calcitrans C. gracilis | Новая Зеландия | Вымер |  Куриный гусь |
.jpg.webp) Garganornis ballmanni | Garganornis ballmanni | Гаргано и Сконтроне | Вымер (Поздний миоцен) |  Гуси[21] |
 Chelychelynechen quassus | Chelychelynechen quassus | Кауаи | Вымер (около 1000 г. н. э.) | _RWD2.jpg.webp) Настоящие утки |
 Ptaiochen pau | Ptaiochen pau | Мауи | Вымер (около 1000 г. н. э.) | |
 Thambetochen chauliodous | Thambetochen chauliodous | Maui Nui | Вымер (около 1000 г. н. э.) | |
 Thambetochen xanion | Thambetochen xanion | Оаху | Вымер (около 1000 г. н. э.) | |
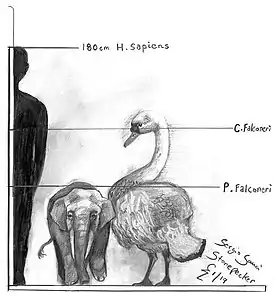 Гигантский лебедь | Cygnus falconeri | Сицилия и Мальта | Вымер (Средний плейстоцен) |  Лебедь-шипун |
| Malacorhynchus scarletti | Malacorhynchus scarletti | Новая Зеландия | Вымер (после 1500 г.) |  Розовоухая утка |
Куриные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Megapodius molistructor | Megapodius molistructor | Новая Каледония и Тонга | Вымер (около 1500 г.) |  Большеноги |
| Megavitiornis altirostris | Megavitiornis altirostris | Фиджи | Вымер | _Male.jpg.webp) Курообразные |
 Sylviornis neocaledoniae | Sylviornis neocaledoniae | Новая Каледония и Пен | Вымер | |
Журавлеобразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Рыжий маврикийский пастушок | Aphanapteryx bonasia | Маврикий | Вымер (около 1700 г.) |  Пастушковые |
 Diaphanapteryx hawkinsi | Diaphanapteryx hawkinsi | Чатем | Вымер (около 1900 г.) | |
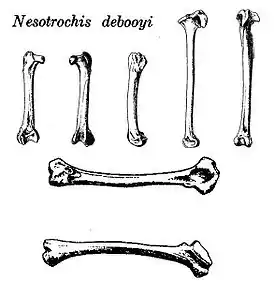 Пастушок Дебуа | Nesotrochis debooyi | Пуэрто-Рико и Виргинские острова | Вымер | |
| Nesotrochis picapicensis | Nesotrochis picapicensis | Куба | Вымер | |
| Nesotrochis steganinos | Nesotrochis steganinos | Гаити | Вымер | |
 Такахе | Porphyrio hochstetteri | Южный (остров, Новая Зеландия), Новая Зеландия | Под угрозой исчезновения | |
 Porphyrio mantelli | Porphyrio mantelli | Северный (остров, Новая Зеландия), Новая Зеландия | Вымер (около 1900 г.) | |
 Aptornis defossor | Aptornis defossor A. otidiformis | Новая Зеландия | Вымер |  Мадагаскарский пушистый погоныш[22] |
 Fulica chathamensis | Fulica chathamensis | Чатем | Вымер (около 1500 г.) | _non-breeding.jpg.webp) Хохлатая лысуха и другие лысухи |
 Маскаренская лысуха | Fulica newtonii | Маврикий и Реюньон | Вымер (около 1700 г.) | |
| Fulica prisca | Fulica prisca | Новая Зеландия | Вымер (около 1280 г.) | |
 Porphyrio coerulescens | Porphyrio coerulescens | Реюньон | Вымер (около 1730 г.) |  Султанки |
Голубиные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Венценосный голубь Вити-Леву | Natunaornis gigoura | Вити-Леву, Фиджи | Вымер | _in_TMII_Birdpark.jpg.webp) Венценосные голуби |
 Родригесский дронт | Pezophaps solitaria | Родригес | Вымер (около 1778 г.) |  Гривистый голубь |
 Маврикийский дронт | Raphus cucullatus | Маврикий | Вымер (около 1662 г.) |
Хищные птицы
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Беркут пещеры Лико | Aquila chrysaetos simurgh | Крит | Вымер (Поздний плейстоцен) |  Беркут |
| Buteogallus borrasi[23] | Buteogallus borrasi | Куба | Вымер |  Мексиканский крабовый канюк и другие ястребы |
| Гигантский ястреб | Gigantohierax sp. | Куба | Вымер | |
| Titanohierax gloveralleni | Titanohierax gloveralleni | Куба, Гаити и Багамские Острова | Вымер | |
| Ямайская каракара | Caracara tellustris | Ямайка | Вымер |  Каракары |
| Circus eylesi | Circus eylesi | Новая Зеландия | Вымер (около 1000 г. н. э.) |  Болотный лунь |
| Орлы острова Гаргано | Garganoaetus freudenthali G. murivorus | Гаргано | Вымер (Поздний миоцен) | Aquila delphinensis |
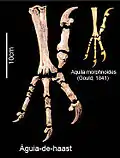 Орёл Хааста | Hieraaetus moorei | Новая Зеландия | Вымер (около 1400 г.) |  Австралийский орёл-карлик |
 Филиппинский орёл | Pithecophaga jefferyi | Филиппины | На грани исчезновения |  Орёл-скоморох[24] |
Попугаеобразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Попугаи пляжа Анакена | Два безымянных вида | Остров Пасхи | Вымер |  Другие попугаи |
 Heracles inexpectatus | Heracles inexpectatus | Новая Зеландия | Вымер (Миоцен) | |
 Какапо | Strigops habroptilus | Новая Зеландия | На грани исчезновения | |
 Маврикийский чубатый попугай | Lophopsittacus mauritianus | Маврикий | Вымер (около 1680 г.) | -_Female_on_a_Neem_(Azadirachta_indica)_tree_at_Hodal_Iws_IMG_1279.jpg.webp) Попугаи подсемейства Psittaculinae |
Совообразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Критский сыч | Athene cretensis | Крит | Вымер (Плейстоцен) | .jpg.webp) Домовой сыч |
 Кубинская гигантская сова | Ornimegalonyx spp. | Куба | Вымер (Плейстоцен) |  Неясыти |
 Большая гигантская сова Гаргано | Tyto gigantea | Гаргано | Вымер (Поздний миоцен) |  Обыкновенная сипуха |
 Tyto pollens | Tyto pollens | Андрос, Багамские Острова | Вымер (около 1600 г.) | |
 Tyto riveroi | Tyto riveroi | Куба | Вымер | |
 Tyto robusta | Tyto robusta | Гаргано | Вымер (Ранний плиоцен) | |
Козодоеобразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Новозеландский совиный козодой | Aegotheles novazelandiae | Новая Зеландия | Вымер (около 1200 г.) |  Австралийский совиный козодой |
 Черноспинный совиный козодой | Aegotheles savesi | Новая Каледония | На грани исчезновения |
Воробьинообразные
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Corvus moriorum | Corvus moriorum | Чатем | Вымер | Новозеландский ворон |
 Emberiza alcoveri | Emberiza alcoveri | Тенерифе | Вымер (после 1 г. н. э.) |  Emberiza cabanisi |
| Hemignathus vorpalis | Hemignathus vorpalis | Гавайи | Вымер (после 1000 г.) | .jpg.webp) Вьюрковые |
| Тасманийский расписной малюр | Malurus cyaneus cyaneus | Тасмания | Нет угрозы исчезновения |  Прекрасный расписной малюр |
| Расписной малюр острова Кенгуру | Malurus cyaneus ashbyi | Кенгуру | Нет угрозы исчезновения | |
| Pachyplichas yaldwyni | Pachyplichas yaldwyni | Южный (остров, Новая Зеландия) | Вымер |  Другие воробьинообразные |
 Zosterops lateralis chlorocephalus | Zosterops lateralis chlorocephalus | Группа островов на Австралийском Большом Барьерном рифе | Неизвестно |  Zosterops lateralis |
Птерозавры
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Хацегоптерикс | H. thambema | Остров Hateg | Вымер (Поздний мел) |  Кетцалькоатль |
Игуановые
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник | Островное / материковое соотношение длины и массы |
|---|---|---|---|---|---|
 Brachylophus gibbonsi[25] | Brachylophus gibbonsi | Тонга | Вымер (около 800 г. до н. э.) |  Южноамериканские игуаны | |
 Lapitiguana impensa[26] | Lapitiguana impensa | Фиджи | Вымер (около 1000 г. до н. э.) | ||
 Sauromalus hispidus | Sauromalus hispidus | Анхель-де-ла-Гуарда, Нижняя Калифорния | Виды, близкие к уязвимому положению | Sauromalus australis | MR ≈ 5[27] |
 Sauromalus varius | Sauromalus varius | Остров San Esteban, Нижняя Калифорния | Вымирающие виды | MR ≈ 5[27] |
Гекконовые
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник | Островное / материковое соотношение длины и массы |
|---|---|---|---|---|---|
 Hoplodactylus delcourti | Hoplodactylus delcourti | Новая Зеландия | Вымер (около 1870 г.) |  Diplodactylidae | LR ≈ 6.75 [lower-alpha 3] |
 Гигантский геккон-бананоед | Rhacodactylus leachianus | Новая Каледония | Нет угрозы исчезновения | LR ≈ 4.4 [lower-alpha 4] MR ≈ 60 [lower-alpha 5] | |
 Гигантский дневной геккон | Phelsuma gigas | Родригес | Вымер (около 1850 г.) |  Дневные гекконы |
Сцинковые
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Chioninia vaillanti | Chioninia vaillanti | Кабо-Верде | Вымирающие виды |  Материковые сцинки |
 Кабовердеский гигантский сцинк | Macroscincus coctei | Кабо-Верде | Вымер (около 1900 г.) | |
 Leiolopisma mauritiana | Leiolopisma mauritiana | Маврикий | Вымер (около 1600 г.) | Материковые сцинки |
| Phoboscincus bocourti | Phoboscincus bocourti | Пен у Новой Каледонии | Вымирающие виды |  Материковые сцинки |
| Plestiodon kishinouyei | Plestiodon kishinouyei | Мияко и Яэяма, Япония | Уязвимые виды | _%E8%97%8D%E5%B0%BE%E7%9F%B3%E9%BE%8D%E5%AD%90.jpg.webp) Азиатские Плестиодоны |
Настоящие ящерицы
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Gallotia auaritae | Gallotia auaritae | Пальма | На грани исчезновения |  Psammodromus |
 Gallotia bravoana | Gallotia bravoana | Гомера | На грани исчезновения | |
 Gallotia goliath[31] | Gallotia goliath | Тенерифе | Вымер (около 1500 г.) | |
 Gallotia simonyi | Gallotia simonyi | Иерро | На грани исчезновения | |
 Gallotia stehlini | Gallotia stehlini | Гран-Канария | Виды под наименьшей угрозой | |
Змеи
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
| Crotalus mitchellii angelensis | Crotalus mitchellii angelensis | Анхель-де-ла-Гуарда в Нижней Калифорнии | Виды под наименьшей угрозой | _(21705787199).jpg.webp) Crotalus mitchellii |
| Elaphe quadrivirgata[32] | Elaphe quadrivirgata | Остров Tadanae-jima в Токио | Неизвестно |  Малочешуйчатый лазающий полоз |
 Notechis scutatus | Notechis scutatus | Острова Mount Chappell, Williams, Hopkins, и архипелаг Нуитс (Южная Австралия)[33] | Виды под наименьшей угрозой |  Тигровая змея |
| Rhinocheilus lecontei etheridgei | Rhinocheilus lecontei etheridgei | Остров Жака Кусто у Южной Нижней Калифорнии | Неизвестно |  Длинноносый уж |
Сомнительные примеры
- Комодский дракон Флореса и близлежащих островов, самая крупная из ныне живущих ящериц, и похожий (вымерший) гигантский варан из Тимора считаются примерами гигантских островных хищников. Поскольку острова, как правило, предлагают ограниченное количество пищи и территории, их хищные млекопитающие (если они есть) обычно меньше континентальных. Эти случаи связаны с экзотермическими хищниками на островах, слишком маленьких для того, чтобы поддерживать конкуренцию среди млекопитающих. Однако эти ящерицы не так велики, как их вымершая австралийская родственница мегалания, и было высказано предположение, основанное на ископаемых свидетельствах, что предки этих варанидов сначала развили свои большие размеры в Австралии, а затем расселились в Индонезии.[34] Если это правда, то они будут рассматриваться не как островные гиганты, а как примеры филетического гигантизма. Эта интерпретация подтверждается свидетельствами существования ящерицы Varanus sivalensis в плиоценовой Индии, сопоставимой по размеру с komodoensis.[34] Тем не менее, учитывая, что Австралия часто описывается как самый большой остров в мире и что связанная с ней мегалания, самая крупная наземная ящерица, известная в ископаемой летописи, была ограничена Австралией, восприятие крупнейших Австралазийских/индонезийских ящериц как островных гигантов всё ещё может иметь некоторую обоснованность.
- Гигантские черепахи на Галапагосских и Сейшельских островах, самые крупные из ныне живущих черепах, а также вымершие черепахи Маскаренских и Канарских островов часто считаются примерами островного гигантизма. Однако во время плейстоцена черепахи сопоставимого размера или более крупные встречались в Австралии (Meiolania), южной Азии (Megalochelys), Мадагаскаре (Aldabrachelys), Северной Америке[35] (Hesperotestudo) и Южной Америке[36] (Chelonoidis, тот же род, который сейчас встречается на Галапагосских островах[37]) и на ряде других, более доступных островов.[35] В позднем плиоцене они также присутствовали в Африке.[38] Нынешняя ситуация, когда крупные черепахи встречаются только на отдалённых островах, по-видимому, отражает то, что эти острова были открыты людьми недавно и не были сильно заселены, что делает этих черепах менее подверженными чрезмерной эксплуатации.
Амфибии
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник | Островное / материковое соотношение длины и массы |
|---|---|---|---|---|---|
| Гигантская древесная лягушка Сан-Томе | Hyperolius thomensis[39] | Сан-Томе | Вымирающие виды |  Африканские красные лягушки | |
| Пальмовая древесная лягушка | Leptopelis palmatus[39] | Принсипи | Уязвимые виды |  Leptopelis rufus | LR ≈ 1.2 [lower-alpha 6] |
| Гигантская земляная лягушка Фиджи | Platymantis megabotoniviti[42] | Вити-Леву, Фиджи | Вымер | _from_mid-elevation_of_Mt._Cagua_-_ZooKeys-266-001-g019.jpg.webp) Азиатские островницы | |
| Гигантская травяная лягушка Сан-Томе | Ptychadena newtoni[39] | Сан-Томе | Вымирающие виды | %252C_Andasibe%252C_Madagascar_(14156831413).jpg.webp) Гребнистая лягушка |
Членистоногие
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
.jpg.webp) Пальмовый вор | Birgus latro | Острова Индийского океана и Полинезия[43] | Неизвестно |  Раки-отшельники Coenobita |
 Deinacrida | Deinacrida spp. | Новая Зеландия | Различная | Anostostomatidae |
| Garypus titanius[44] | Garypus titanius | Остров Boatswain Bird | Неизвестно |  Garypoidea |
 Gromphadorhina portentosa | Gromphadorhina spp. | Мадагаскар | Виды под наименьшей угрозой |  Blaberidae |
 Labidura herculeana | Labidura herculeana | Остров Святой Елены | Вымер (около 1967 г.) |  Прибрежная уховёртка |
 Megachile pluto | Megachile pluto | Северное Малуку | Уязвимые виды |  Callomegachile |
 Megalara garuda | Megalara garuda | Горы Mekongga, Сулавеси | Неизвестно |  Осы Crabroninae |
 Мадагаскарские гигантские многоножки | Microsphaerotherium spp. Sphaeromimus spp. Zoosphaerium spp. | Мадагаскар | Неизвестно |  Индийские гигантские многоножки (Arthrosphaera) |
.jpg.webp) Orsonwelles | Orsonwelles spp. | Гавайи | Неизвестно |  Линифииды |
| Thaumatogryllus conanti | Thaumatogryllus conanti | Нихоа | Неизвестно | .jpg.webp) Сверчки стеблевые |
 Xixuthrus heros[45] | Xixuthrus heros | Вити-Леву, Фиджи | Уязвимые виды | _(8756596643).jpg.webp) Австралазийский Xixuthrus |
| Xixuthrus terribilis | Xixuthrus terribilis | Тавеуни, Фиджи | Неизвестно |
Брюхоногие
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Paryphanta | Paryphanta spp. Powelliphanta spp. | Новая Зеландия | Виды, близкие к уязвимому положению |  Другие брюхоногие |
Растения
Островной гигантизм встречается не только среди животных, но и среди растений. На Сахалине растет горец сахалинский (Polygonum sachalinense); многие другие сахалинские растения также отличаются гигантизмом. Некоторые виды кустарников и трав на островах не уступают своими размерами небольшим деревьям, например подорожник древовидный (Plantago arborescens) с Канарских островов. В дополнение к увеличению размера островные травянистые растения могут также проявлять «островную древесность». Наиболее примечательными примерами являются мегатравы субантарктических островов Новой Зеландии.[46] Увеличение размера листьев и семян было также отмечено у некоторых островных видов независимо от формы роста (травянистый, кустарниковый или древесный).[47]
| Пример | Научное наименование | Родной ареал | Текущее состояние | Континентальный родственник |
|---|---|---|---|---|
 Anisotome latifolia | Anisotome latifolia | Кэмпбелл и Окленд | Неизвестно | .jpg.webp) Зонтичные |
 Бульбинелла Росса | Bulbinella rossii | Кэмпбелл и Окленд | Неизвестно |  Новозеландская лилия маори |
 Corokia macrocarpa[47][48] | Corokia macrocarpa | Чатем | Неизвестно |  Corokia cotoneaster[49] |
 Damnamenia vernicosa | Damnamenia vernicosa | Окленд и Кэмпбелл | Неизвестно |  Астровые |
.jpg.webp) Дендросициос[50] | Dendrosicyos socotranus | Сокотра | Уязвимые виды |  Cucurbitoideae |
 Сейшельская пальма[51][50] | Lodoicea maldivica | Сейшелы | Вымирающие виды | .jpg.webp) Borasseae |
 Pleurophyllum criniferum | Pleurophyllum criniferum | Острова Антиподов, Окленд и Кэмпбелл | Неизвестно |  Цинерария |
 Pleurophyllum hookeri | Pleurophyllum hookeri | Маккуори, Окленд и Кэмпбелл | Неизвестно | |
.jpg.webp) Pleurophyllum speciosum | Pleurophyllum speciosum | Кэмпбелл и Окленд | Неизвестно | |
 Rhopalostylis[47] | Rhopalostylis aff. sapida | Чатем | Неизвестно |  Ропалостилис вкусный |
 Stilbocarpa polaris | Stilbocarpa polaris | Маккуори и Новозеландские субантарктические острова | Уязвимые виды |  Аралиевые |
Заметки
- Сокращение хищничества на островах часто также приводит к послушному поведению островных видов добычи, тенденция, которая была проанализирована у ящериц.[3][4]
- Самый ранний известный новозеландский предок киви, предположительно недавно прибывший из Австралии.[20]
- Исходя из предполагаемой общей длины H. delcourti, ~23.6 дюйма,[28] и средняя длина представителей Диплотактилюсов, самого специфического рода австралийских гекконов-диплодактилюсов, ~3.5 дюйма.[29]
- На основе средней общей длины более крупных подвидов, R. l. leachianus, ~15.5 дюйма,[30] и средняя длина представителей Диплотактилюсов, самого специфического рода австралийских гекконов-диплодактилюсов, ~3.5 дюйма.[29]
- На основе средней массы более крупного подвида, R. l. leachianus, ~240 г,[30] со средним весом представителей Диплотактилюсов, самого специфического рода австралийских гекконов-диплодактилюсов, ~4 г.[29]
- На основе средней длины морды самки до ноздрей (SVL) L. palmatus, ~96 мм,[40] при средней длине SVL самки L. rufus, ~80 мм.[41]
Примечания
- Raia, P.; Meiri, S. (August 2006). “The island rule in large mammals: paleontology meets ecology”. Evolution. 60 (8): 1731—1742. DOI:10.1111/j.0014-3820.2006.tb00516.x.
- Herczeg, G. B.; Gonda, A. L.; Merilä, J. “Evolution of Gigantism in Nine-Spined Sticklebacks”. Evolution. 63 (12): 3190—3200. DOI:10.1111/j.1558-5646.2009.00781.x. PMID 19624722.
- Cooper, W. E.; Pyron, R. A.; Garland, T. “Island tameness: Living on islands reduces flight initiation distance”. Proceedings of the Royal Society B: Biological Sciences. 281 (1777): 20133019. DOI:10.1098/rspb.2013.3019. PMC 3896029. PMID 24403345.
- Yong, E. “Islands make animals tamer”. Nature. DOI:10.1038/nature.2014.14462.
- Jaffe, A. L.; Slater, G. J.; Alfaro, M. E. “The evolution of island gigantism and body size variation in tortoises and turtles”. Biology Letters. 7 (4): 558—561. DOI:10.1098/rsbl.2010.1084. PMC 3130210. PMID 21270022.
- Barahona, F.; Evans, S.E.; Mateo, J.A.; Garcia-Marquez, M.; Lopez-Jurado, L.F. (March 2000). “Endemism, Gigantism and Extinction in Island Lizards: The Genus Gallotia on the Canary Islands”. Journal of Zoology. 250 (3): 373—388. DOI:10.1017/s0952836900003101. HDL:10553/19918.
- Keehn, J. E.; Nieto, N. C.; Tracy, C. R.; Gienger, C. M.; Feldman, C. R. “Evolution on a desert island: Body size divergence between the reptiles of Nevada's Anaho Island and the mainland around Pyramid Lake”. Journal of Zoology. 291 (4): 269—278. DOI:10.1111/jzo.12066.
- Lomolino, M. V. “Body size evolution in insular vertebrates: generality of the island rule”. Journal of Biogeography. 32 (10): 1683—1699. DOI:10.1111/j.1365-2699.2005.01314.x.
- Filin, I.; Ziv, Y. “New Theory of Insular Evolution: Unifying the Loss of Dispersability and Body-mass Change” (PDF). Evolutionary Ecology Research. 6: 115—124.
- Turvey, S. T. (2006). “A new genus and species of giant hutia (Tainotherium valei) from the Quaternary of Puerto Rico: an extinct arboreal quadruped?”. Journal of Zoology. 270 (4): 585—594. DOI:10.1111/j.1469-7998.2006.00170.x.
- Torres-Roig, E.; Agustí, J.; Bover, P.; Alcover, J.A. (2017). “A new giant cricetine from the basal Pliocene of Mallorca (Balearic Islands, western Mediterranean): biostratigraphic nexus with continental mammal zones”. Historical Biology. 31 (5): 559—573. DOI:10.1080/08912963.2017.1377194.
- Freudenthal, M. (1985). Cricetidae (Rodentia) from the Neogene of Gargano (Prov. of Foggia, Italy). Rijksmuseum van Geologie en Mineralogie.
- St Kilda's 'super-sized' field mice studied. BBC.
- Error
- Timm, R. M.; Weijola, V.; Aplin, K. P.; Donnellan, S. C.; Flannery, T. F.; Thomson, V.; Pine, R. H. “A new species of Rattus (Rodentia: Muridae) from Manus Island, Papua New Guinea”. Journal of Mammalogy. 97 (3): 861—878. DOI:10.1093/jmammal/gyw034.
- http://www.raco.cat/index.php/Orsis/article/viewFile/24434/24268
- Daams, R.; Freudenthal, M. (1985). “Stertomys laticrestatus, a new glirid (dormice, Rodentia) from the insular fauna of Gargano (Prov. of Foggia, Italy)”. Scripta Geologica. 77: 21—27.
- MacPhee, R.D.E., Iturralde-Vinent, M.A., and Gaffney, E.S. “Domo de Zaza, an Early Miocene Vertebrate Locality in South-Central Cuba, with Notes on the Tectonic Evolution of Puerto Rico and the Mona Passage”. American Museum Novitates. 3394 (1): 1—42. DOI:10.1206/0003-0082(2003)394<0001:DDZAEM>2.0.CO;2. HDL:2246/2820.
- Late Cretaceous Animals of Romania's Haţeg Island--a More Complex View.
- Worthy, Trevor H. Miocene fossils show that kiwi (Apteryx, Apterygidae) are probably not phyletic dwarves. — Paleornithological Research 2013, Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution, 2013.
- Pavia, M.; Meijer, H. J. M.; Rossi, M. A.; Göhlich, U. B. “The extreme insular adaptation of Garganornis ballmanni Meijer, 2014: a giant Anseriformes of the Neogene of the Mediterranean Basin”. Royal Society Open Science. 4 (1): 160722. DOI:10.1098/rsos.160722. PMC 5319340. PMID 28280574.
- African Origins for the Enigmatic Adzebill » Canterbury Museum
- Naish, Darren Titan-hawks and other super-raptors. Tetrapod Zoology blog. ScienceBlogs LLC.
- Lerner, Heather R. L.; Mindell, David P. (2005). “Phylogeny of eagles, Old World vultures, and other Accipitridae based on nuclear and mitochondrial DNA”. Molecular Phylogenetics and Evolution. 37 (2): 327—346. DOI:10.1016/j.ympev.2005.04.010. PMID 15925523.
- Pregill, G. K.; Steadman, D. W. “South Pacific Iguanas: Human Impacts and a New Species”. Journal of Herpetology. 38 (1): 15—21. DOI:10.1670/73-03A. JSTOR 1566081.
- Pregill, G. K.; Worthy, T. H. “A New Iguanid Lizard (Squamata, Iguanidae) from the Lare Quaternary of Fiji, Southwest Pacific”. Herpetologica. 59 (1): 57—67. DOI:10.1655/0018-0831(2003)059[0057:ANILSI]2.0.CO;2. ISSN 0018-0831.
- Petren, K.; Case, T. J. (1997). “A Phylogenetic Analysis of Body Size Evolution and Biogeography in Chuckwallas (Sauromalus) and Other Iguanines”. Evolution. 51 (1): 206—219. DOI:10.1111/j.1558-5646.1997.tb02402.x.
- Wilson, K.-J. Flight of the Huia: Ecology and Conservation of New Zealand's Frogs, Reptiles, Birds and Mammals. — Canterbury University Press, 2004. — ISBN 0-908812-52-3.
- Stewart, C. Diplodactylus Geckos of Australia. reptilesmagazine.com/.
- Bergman, J.; Hamper, R. New Caledonian Giant Gecko Care Sheet. reptilesmagazine.com/ (2016).
- Maca-Meyer, N.; Carranza, S.; Rando, J. C.; Arnold, E. N.; Cabrera, V. M. “Status and relationships of the extinct giant Canary Island lizard Gallotia goliath (Reptilia: Lacertidae), assessed using ancient mtDNA from its mummified remains” (PDF). Biological Journal of the Linnean Society. 80 (4): 659—670. DOI:10.1111/j.1095-8312.2003.00265.x.
- https://www.jstage.jst.go.jp/article/hsj2000/21/1/21_1_43/_pdf
- Keogh, J. S.; Scott, I. A. W.; Hayes, C. “Rapid and repeated origin of insular gigantism and dwarfism in Australian tiger snakes”. Evolution. 59 (1): 226—233. DOI:10.1111/j.0014-3820.2005.tb00909.x.
- Hocknull, S. A.; Piper, P. J.; van den Bergh, G. D.; Due, R. A.; Morwood, M. J.; Kurniawan, I. (2009). “Dragon's Paradise Lost: Palaeobiogeography, Evolution and Extinction of the Largest-Ever Terrestrial Lizards (Varanidae)”. PLoS ONE [англ.]. 4 (9): e7241. DOI:10.1371/journal.pone.0007241. PMC 2748693. PMID 19789642.
- Hansen, D. M.; Donlan, C. J.; Griffiths, C. J.; Campbell, K. J. “Ecological history and latent conservation potential: large and giant tortoises as a model for taxon substitutions” (PDF). Ecography [англ.]. 33 (2): 272—284. DOI:10.1111/j.1600-0587.2010.06305.x.
- Cione, A. L.; Tonni, E. P.; Soibelzon, L. (2003). “The Broken Zig-Zag: Late Cenozoic large mammal and tortoise extinction in South America” (PDF). Rev. Mus. Argentino Cienc. Nat. N. S. [англ.]. 5 (1): 1—19. DOI:10.22179/REVMACN.5.26. ISSN 1514-5158. Архивировано из оригинала (PDF) 2011-07-06.
- Fariña, R.A., Vizcaíno, S.F. & De Iuliis, G. (2013) Megafauna: Giant Beasts of South America. Indiana University Press, 448 pages. (англ.)
- Harrison, T. Tortoises (Chelonii, Testudinidae) // Paleontology and Geology of Laetoli: Human Evolution in Context, Vol. 2: Fossil Hominins and the Associated Fauna : [англ.]. — Springer Science+Business Media, 2011. — P. 479–503. — ISBN 978-90-481-9961-7. — doi:10.1007/978-90-481-9962-4_17.
- Measey, G. J.; Vences, M.; Drewes, R. C.; Chiari, Y.; Melo, M.; Bourles, B. (2006). “Freshwater paths across the ocean: molecular phylogeny of the frog Ptychadena newtoni gives insights into amphibian colonization of oceanic islands”. Journal of Biogeography. 34 (1): 7—20. DOI:10.1111/j.1365-2699.2006.01589.x.
- Leptopelis palmatus. amphibiaweb.org. University of California, Berkeley (2008).
- Leptopelis rufus. amphibiaweb.org. University of California, Berkeley (2008).
- Worthy, T. H. (2001). “A New Species of Platymantis (Anura: Ranidae) from Quaternary Deposits On Viti Levu, Fiji”. Palaeontology. 44 (4): 665—680. DOI:10.1111/1475-4983.00197.
- Ни пальмовые воры, ни их родственники не могут плавать кроме как в стадии личинки, что практически делает взрослых особей сухопутными животными. Пальмовые воры могут весить более 4 кг (9 фунтов); самые крупные раки-отшельники родственного рода Coenobita, C. brevimanus из прибрежных районов Африки и Азии, достигает всего 230 граммов (0,5 фунта).
- Ascension Island Biodiversity Action Plan: Garypus titanius species action plan. Georgetown, Ascension Island: Ascension Island Government Conservation Department.
- Keppel, Gunnar; Lowe, Andrew J.; Possingham, Hugh P. (2009). “Changing perspectives on the biogeography of the tropical South Pacific: influences of dispersal, vicariance and extinction”. Journal of Biogeography. 36 (6): 1035—1054. DOI:10.1111/j.1365-2699.2009.02095.x. ISSN 0305-0270.
- Bowen, Lizabeth; Vuren, Dirk Van (1997). “Insular Endemic Plants Lack Defenses Against Herbivores”. Conservation Biology. 11 (5): 1249—1254. DOI:10.1046/j.1523-1739.1997.96368.x. ISSN 0888-8892.
- Small islands breed big seeds — Science Learning Hub
- T.E.R:R.A.I.N - Taranaki Educational Resource: Research, Analysis and Information Network - Corokia macrocarpa (Chatham Is Korokio)
- T.E.R:R.A.I.N - Taranaki Educational Resource: Research, Analysis and Information Network - Corokia cotoneaster (Korokio)
- Burns, K. C. Evolution in Isolation: The Search for an Island Syndrome in Plants. — Cambridge University Press, May 2019. — ISBN 978-1108379953. — doi:10.1017/9781108379953.
- Proctor, J. Biogeography and Ecology of the Seychelles Islands. — W. Junk, 1984. — ISBN 978-90-6193-881-1.
Литература
- Mazza, P. P. A., Rossi, M. A., & Agostini, S. Hoplitomerycidae (Late Miocene, Italy), an Example of Giantism in Insular Ruminants // Journal of Mammalian Evolution. — 2015. — Vol. 22, № 2. — P. 271—277. — doi:10.1007/s10914-014-9277-2.

