Антиаритмические препараты
Антиаритмические препараты — группа лекарственных средств, применяющихся при разнообразных нарушениях сердечного ритма, таких как экстрасистолия, мерцательная аритмия, пароксизмальная тахикардия, фибрилляция желудочков и др.
Классификация
По локализации действия
- Средства, влияющие непосредственно на миокард
- Мембраностабилизирующие препараты
- Средства, увеличивающие продолжительность потенциала действия
- Блокаторы кальциевых каналов (антагонисты ионов кальция)
- Препараты калия
- Сульфат магния
- Средства, влияющие на иннервацию сердца
- β-адреноблокаторы
- β-адреномиметики
- Симпатомиметики (в настоящее время практически не применяются)
- М-холиноблокаторы
- Средства, влияющие и на миокард, и на иннервацию сердца
По применению в клинической практике
- Средства, применяющиеся при тахиаритмиях и экстрасистолиях
- I класс. Мембраностабилизирующие препараты
- II класс. β-адреноблокаторы
- III Класс. Средства, увеличивающие продолжительность потенциала действия
- IV Класс. Блокаторы кальциевых каналов (антагонисты ионов кальция)
- V Класс. Прочие средства
- Препараты калия
- Сердечные гликозиды
- Аденозин
- Сульфат магния
- Средства применяющиеся при блокадах сердца.
- β-адреномиметики
- Симпатомиметики (в настоящее время практически не применяются)
- М-холиноблокаторы
Препараты, применяющиеся при тахиаритмиях и экстрасистолиях
| Класс | Наименование | Пример | Механизм действия | Клиническое применение[1] |
|---|---|---|---|---|
| Ia | Блокаторы натриевых каналов |
|
Умеренная блокада натриевых каналов |
|
| Ib | Активаторы калиевых каналов | Активация калиевых каналов. Незначительная блокада натриевых каналов |
| |
| Ic | Блокаторы натриевых каналов |
|
Выраженная блокада натриевых каналов |
|
| II | β-адреноблокаторы |
|
Ингибирование влияния симпатической нервной системы на миокард
У пропранолола имеется мембраностабилизирующее действие (I класс) |
|
| III | Средства, увеличивающие продолжительность потенциала действия | Блокада калиевых каналов
Соталол обладает также β-блокирующей активностью[2] |
| |
| IV | Блокаторы кальциевых каналов | Блокада медленных потенциалзависимых кальциевых каналов |
| |
| V | Прочие средства |
|
Сердечные гликозиды и аденозин вызывают угнетение атриовентрикулярного узла. Сердечные гликозиды за счет повышения тонуса блуждающего нерва, аденозин — за счет связывания с А1-аденозиновыми рецепторами. | Сердечные гликозиды и аденозин Используются при наджелудочковых аритмиях, особенно при мерцательной аритмии и сопутствующей сердечной недостаточности. Сульфат магния применяется при пароксизмальной желудочковой тахикардии типа «пируэт» (Torsade de Pointe) |
Краткий очерк по электрофизиологии сердца
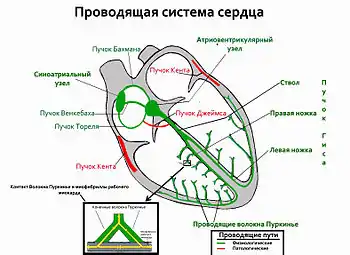

Миокард относится к активно возбудимым средам.[3] Он способен как генерировать, так и проводить электрические импульсы. Зародившись в синоатриальном узле, импульс по миокарду предсердий и межпредсердным путям быстрого проведения (пучки Бахмана, Венкебаха и Тореля) устремляется к атриовентрикулярному узлу, где скорость проведения самая низкая в проводящей системе сердца. В результате возникает так называемая атриовентрикулярная задержка. Это способствует тому, что предсердия успевают сократиться раньше желудочков. Далее импульс проходит в ствол пучка Гиса, затем через ножки пучка Гиса и проводящие волокна Пуркинье попадает в рабочий миокард желудочков, приводя к их сокращению (Рис. 1).[4] При некоторых формах врожденной патологии отмечается дополнительных путей предсердно-желудочкового проведения: пучки Кента при синдроме Вольфа-Паркинсона-Уайта[5] и пучок Джеймса при синдроме Клерка-Леви-Кристеско[6]. Пучки Кента обычно расположены с латеральных сторон фиброзных колец и связывают миокард предсердий с базальными отделами миокарда желудочков. Пучок Джеймса начинается в миокарде, чаще всего, левого предсердия и, огибая с медиальной стороны фиброзное кольцо, проникает в межжелудочковую перегородку, где напрямую контактирует со стволом пучка Гиса. Наличие этих пучков в некоторых случаях может приводить к пароксизмам тахикардии.
Способность к зарождению импульсов в норме имеется только у клеток проводящей системы сердца. Выделяют несколько фаз их потенциалов действия (Рис. 2).[4]
- Фаза 0 — быстрая деполяризация. Генерируется входящим кальциевым током в синоатриальном и атриовентрикулярном узлах и входящим натриевым током в стволе и ножках пучка Гиса, а также проводящих волокнах Пуркинье.
- Фаза 1 — начальная реполяризация. Генерируется исходящим калиевым током.
- Фаза 2 — плато. Возникает благодаря входящему кальциевому току.
- Фаза 3 — конечная реполяризация. Как и фаза 1, генерируется исходящим калиевым током.
- Фаза 4 — медленная диастолическая деполяризация. Возникает благодаря входящему кальциевому току в узлах и входящему натриевому току в остальных отделах проводящей системы сердца.
Потенциал действия узлов значительно отличается от потенциала действия других областей сердца. В нем практически отсутствуют фаза 1 и фаза 2.
Потенциал действия рабочего миокарда желудочков очень похож на потенциал действия конечного волокна Пуркинье. Основное отличие — фаза 4. У волокон Пуркинье это медленная диастолическая деполяризация а у рабочего кардиомиоцита — потенциал покоя.
Потенциал действия патологических путей атриовентрикулярного проведения: Кента и Джеймса очень похож на таковой у ножек пучка Гиса и волокон Пуркинье. Эти пути также возбуждаются входящим натриевым током.
Этиология и патогенез аритмий. Основные эффекты антиаритмических препаратов
Аритмии бывают функциональными и органическими.
Функциональные аритмии могут встречаться у здоровых людей при чрезмерной физической нагрузке, психоэмоциональном возбуждении, лихорадке и др. Выделяющиеся при этих состояниях адреналин и норадреналин повышают вход ионов натрия и кальция внутрь проводящих кардиомиоцитов. Это приводит к снижению мембранного потенциала клеток, повышению их возбудимости и возникновению эктопических очагов автоматизма. Реже причина возникновения функциональных аритмий — так называемый повторный вход возбуждения (англ. re-entry).
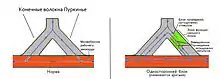
Аритмии, связанные с органическими заболеваниями сердца (ишемическая болезнь сердца, инфаркт миокарда, миокардиты и др.) чаще возникают именно по механизму повторного входа возбуждения. При этом в одном из конечных волокон Пуркинье возникает неполный однонаправленный блок проведения возбуждения к миофибрилле рабочего миокарда предсердий или желудочков (рис. 3). Но в этом же месте сохраняется способность антидромного проведения импульса. Если импульс зацикливается один-два раза — возникает экстрасистолия, если три и более — пароксизмальная тахикардия. Это micro re-entry.[7]

При синдромах Вольфа-Паркинсона-Уайта и Клерка-Леви-Кристеско при замедлении узловой атриовентрикулярной проводимости импульс быстрее достигает желудочков по патологическим быстрым путям предсердно-желудочкового проведения: Кента и Джеймса соответственно. При синдроме Вольфа-Паркинсона-Уайта импульс напрямую по Пучку Кента устремляется в миокард желудочков, затем ретроградно попадает в волокна Пуркинье, далее — в пучок Гиса и атриовентрикулярный узел. Затем — в миокард предсердий и опять через пучок Кента — в желудочки (Рис 4.).[5] При синдроме Клерка-Леви-Кристеско электрический стимул по быстрому пучку Джеймса, минуя атриовентрикулярный узел, напрямую попадает в ствол пучка Гиса. А оттуда антидромно в атриовентрикулярный узел, миокард предсердий и вновь в пучок Джеймса и желудочки. Это так называемое macro re-entry. Пароксизмальная тахикардия, возникшая подобным образом, называется реципрокной.
Антиаритмические препараты имеют различные механизмы действия. Но в целом, все они оказывают:
- Отрицательное батмотропное действие — уменьшение возбудимости и автоматизма миокарда. Является положительным, так как устраняет эктопические очаги автоматизма
- Отрицательное дромотропное действие — замедление проводимости в различных отделах сердца. С одной стороны является положительным, так как при аритмиях типа re-entry устраняет повторный антидромный вход возбуждения. Вместе с тем, в местах замедленной проводимости может вызвать неполный однонаправленный блок и аритмию re-entry. Опасно при затруднении атриовентрикулярной проводимости.
- Отрицательное хронотропное действие — замедление частоты сердечных сокращений за счет снижения возбудимости и автоматизма синоатриального узла или других водителей ритма, а также за счет отрицательного дромотропного эффекта на атриовентрикулярную проводимость при мерцательной аритмии. Положительно при тахикардии. Нежелательно при эукардии и опасно при брадикардии.
- Отрицательное инотропное действие — снижение силы сердечных сокращений. Присуще препаратам, блокирующим кальциевые каналы: группы Ia, III и IV, либо опосредованно уменьшающим содержание внутриклеточного кальция (группа II: β-блокаторы). Всегда нежелательно, так как снижает сердечный выброс.
| Показатель | Средства, оказывающие стимулирующее действие | Средства, оказывающие угнетающее действие |
|---|---|---|
| Частота сердечных сокращений | β-адреномиметики, М-холиноблокаторы, хинидин, новокаинамид, дизопирамид | β-адреноблокаторы, сердечные гликозиды, представители групп Ic и III, блокаторы кальциевых каналов (фенилалкиламины и бензотиазепины) |
| Сократимость Миокарда | β-адреномиметики, сердечные гликозиды | β-адреноблокаторы, все представители групп I и III, блокаторы кальциевых каналов (фенилклакиламины и бензотиазепины) |
| Атриовентрикулярная проводимость | β-адреномиметики, М-холиноблокаторы, хинидин, новокаинамид | β-адреноблокаторы, сердечные гликозиды, все представители групп Ic и III, блокаторы кальциевых каналов (фенилклакиламины и бензотиазепины) |
| Автоматизм сердца | β-адреномиметики, сердечные гликозиды | β-адреноблокаторы, все представители групп I и III, блокаторы кальциевых каналов (фенилклакиламины и бензотиазепины) |
Средства, применяющиеся при тахиаритмиях и экстрасистолиях
Группа I. Мембраностабилизирующие препараты
В зависимости от влияния на продолжительность потенциала действия подразделяются на подгруппы Ia, Ib и Ic.[8][9]
Группа Ia. Блокаторы натриевых каналов


Эти препараты тормозят фазу 0 (быструю деполяризацию) потенциала действия в клетках рабочего миокарда предсердий, желудочков, а также желудочковой части проводящей системы сердца: общий ствол и ножки пучка Гиса, проводящие волокна Пуркинье. Электрофизиологическая особенность этих отделов сердца состоит в том, что фаза 0 потенциала действия в них происходит за счет входящего тока ионов натрия внутрь кардиомиоцитов. Частичная блокада потенциалзависимых натриевых каналов приводит к замедлению фазы 0 потенциала действия, что сопровождается некоторым замедлением проводимости в этих отделах сердца, а незначительная блокада калиевых каналов сопровождается небольшим увеличением эффективного рефрактерного периода (рис 5). Благодаря этому, препараты группы Ia переводят неполный однонаправленный блок в конечном волокне Пуркинье в полный двунаправленный (рис. 6). Антидромное распространение электрических имульсов из волокна рабочего миокарда в конечное волокно Пуркинье прерывается, что приводит к блокаде повторного входа возбуждения. На синоатриальный узел препараты группы Ia оказывают слабое влияние, на атриовентрикулярный узел его действие выражено чуть сильнее. Это связано с тем, что фаза 0 и фаза 4 (медленная диастолическая деполяризация) обеспечиваются в синоатриальном узле входящим кальциевым током через медленные кальциевые каналы. В атриовентрикулярном узле за эти фазы отвечает и входящий натриевый ток, хотя доля его невелика. Тем не менее, препараты группы Ia несколько затрудняют атриовентрикулярную проводимость, главным образом, за счёт блокады натриевых каналов в стволе и ножках пучка Гиса, а также в волокнах Пуркинье. Синоатриальный узел препараты этого класса возбуждают за счет М-холиноблокирующего действия. В наименьшей степени это выражено у новокаинамида, достаточно — у хинидина и очень выраженно — у дизопирамида. Поскольку точкой приложения блокаторов натриевых каналов является практически весь рабочий миокард и проводящая система сердца, кроме узлов, они нашли применение при разнообразных нарушениях сердечного ритма: желудочковые аритмии, профилактика и лечение пароксизмов мерцательной аритмии и пароксизмальной тахикардии при синдроме Вольфа-Паркинсона-Уайта. В последнем случае, препараты группы Ia блокируют проводимость в пучке Кента и прерывают повторный вход возбуждения. Блокаторы натриевых каналов являются эффективными средствами, однако широкое применение этих средств ограничивается побочными эффектами, в первую очередь, аритмогенностью, о чем будет сказано ниже. Помимо этого, например, новокаинамид может вызывать лекарственную красную волчанку. В общем и целом можно сказать, что препараты группы Ia обладают умеренным отрицательным батмо-, дромо- и инотропным эффектами. И за счет атропиноподобного действия — положительным хронотропным эффектом.
Группа Ib. Активаторы калиевых каналов

Препараты этой группы незначительно блокируют натриевые каналы и активируют калиевые. Фаза 0 несколько наклоняется, фаза 3 (реполяризация) сокращается. Это приводит к укорочению потенциала действия и эффективного рефрактерного периода (рис. 7). Однако степень укорочения реполяризации больше, чем степень уменьшения рефрактерности то есть фактически происходит относительное увеличение рефрактерного периода. Блокада потенциалзависимых натриевых каналов, а также связанная с активацией калиевых каналов гиперполяризация, удлинняют медленную диастолическую деполяризацию (кроме узлов), что приводит к ослаблению эктопического автоматизма, то есть, эти препараты оказывают выраженное отрицательное батмотропное действие на рабочий миокард желудочков и предсердий, а также на проводящую систему сердца ниже атриовентрикулярного узла. Активаторы калиевых каналов не влияют на узлы, поэтому не вызывают брадикардии и не замедляют атриовентрикулярной проводимости. Лидокаин применяется при желудочковых аритмиях, связанных с острым инфарктом миокарда. Тем не менее, лидокаин противопоказан при полной атриовентрикулярной блокаде, так как при его применении есть риск снижения частоты желудочкового водителя ритма. Благодаря короткому периоду полувыведения, лидокаин назначается внутривенно струйно. Мексилетин применяется при тех же показаниях. Однако, помимо внутривенного введения, он может применяться внутрь. Противопоказан он при атриовентрикулярной блокаде II—III степени. Дифенин, помимо влияния на ионные каналы, влияет на активный транспорт ионов натрия и кальция через клеточные и субклеточные мембраны. Уменьшает уровень натрия в клетке, снижает его поступление, стимулируя Na+/K+-АТФазу, облегчая активный транспорт натрия из клетки. Активаторы калиевых каналов оказывают очень слабые ино-, хроно- и дромотропное действия. Благодаря последнему, они обладают значительно меньшей аритмогенностью по сравнению с группой Ia.
Группа Ic. Блокаторы натриевых каналов

Препараты этой группы блокируют потенциалзависимые натриевые каналы значительно сильнее, чем представители группы Iа, что приводит к большему замедлению фазы 0 потенциала действия. Но, в отличие от препаратов группы Iа практически не влияют на калиевые каналы и длительность потенциала действия (Рис. 8). Также замедляют фазу 4 и угнетают эктопический автоматизм рабочего миокарда, пучка Гиса и проводящих волокон Пуркинье. Применяются в основном при желудочковых аритмиях. Среди мембраностабилизирующих препаратов группа Iс обладает наибольшей аритмогенностью.
Причины аритмогенности антиаритмических препаратов

В волокнах Пуркинье есть участки, находящиеся в состоянии дистрофии, в которых электрический импульс, пусть и замедленно, но распространяется к миофибрилле рабочего миокарда. Антиаритмические препараты группы I блокируют натриевые каналы и способствуют возникновению в таких участках неполного однонаправленного блока и возникновению аритмий повторного входа возбуждения (re-entry; Рис. 9). Чем более у препарата выражено блокирующее действие на натриевые каналы, тем сильнее его аритмогенное действие. Именно поэтому препараты группы Ic имеют наибольшую аритмогенность , группы Ia — умеренную, группы Ib — незначительную. Способность провоцировать аритмии является основным лимитирующим фактором длительного применения препаратов группы I.
Сравнительные характеристики препаратов группы I
| Подгруппа | Скорость фазы 0 | ЭРП | Автоматизм | Соотношение ЭРП/Длительность ПД | Аритмогенность |
|---|---|---|---|---|---|
| Ia | Умеренно замедляется | Незначительно удлиняется | Умеренно снижается | Повышается | Умеренная |
| Ib | Незначительно замедляется | Незначительно сокращается | Умеренно снижается | Уменьшается | Низкая |
| Ic | Значительно замедляется | Не изменяется | Умеренно снижается | Повышается | Высокая |
Группа II. β-блокаторы
Эти препараты блокируют β1-адренергические рецепторы, имеющиеся в во всех отделах сердца. Их блокада приводит к снижению активности ГТФ-связывающего белка Gs. Распад Gs-белка на субъединицы замедляется. Дефицит α-субъединицы приводит к снижению активности фермента аденилатциклазы и превращения АТФ в циклический АМФ (цАМФ). цАМФ, будучи вторичным посредником, активирует протеинкиназу А (цАМФ- зависимую А-киназу). Для активации этого фермента необходимы две молекулы цАМФ, которые связывается с каждой из двух регуляторных субъединиц этого белка. В результате регуляторные единицы отсоединяются от каталитических субъединиц (а те отделяются друг от друга). Активированные каталитические субъединицы А-киназы фосфорилируют различные белки, которые являются её субстратами. При этом происходит перенос фосфатной группы от АТФ на специфический аминокислотный остаток (серин или треонин). В миокарде активация β1-адренергических рецепторов повышает активность натриевых и кальциевых каналов, оказывая положительное хроноторпное, батмотропное, дромотропное и инторопное действие. β-блокаторы оказывают отрицательное батмотропное действие: снижают автоматизм сердечной мышцы, замедляя медленную диастолическую деполяризацию, а также отрицательное дромотропное действие: затрудняют атриовентрикулярную проводимость. Несмотря на то, что β-блокаторы снижают сократимость миокарда, при длительном их применении уменьшается общее периферическое сосудистое сопротивление (ОПСС), поэтому снижения сердечного выброса не происходит. β-блокаторы не обладают аритмогенным эффектом. Более того, при их длительном применении снижается сердечно-сосудистая смертность, в том числе и за счет снижения риска возникновения фатальных аритмий. Подробней см. статью β-блокаторы
Группа III. Средства, увеличивающие продолжительность потенциала действия


Все препараты этой группы блокируют калиевые каналы. Благодаря этому увеличивается процесс реполяризации (фаза 3) и эффективный рефрактерный период.[10] Одним из наиболее популярных и изученных препаратов этой группы является амиодарон. Помимо угнетения калиевых каналов, амиодарон блокирует натриевые и кальциевые каналы. Амиодарон влияет на все отделы рабочего миокарда и проводящей системы сердца. Он оказывает отрицательные батмо-, ино-, хроно- и дромотропный эффекты. Благодаря значительному увеличению ЭРП (рис. 10), амиодарон обладает выраженным антиаритмическим действием, подкрепляющимся также блокадой натриевых каналов. В отличие от препаратов группы I, амиодарон обладает незначительной аритмогенностью. Это связано с тем, что при одновременной блокаде натриевых и калиевых каналов возникает и замедление проводимости, и увеличение ЭРП, что блокирует и повторный вход возбуждения, и переводит участки с замедленным проведением в полный двунаправленный блок (Рис. 11). Амиодарон также неконкурентно блокирует α-адренорецепторы, понижая ОПСС и снижая нагрузку на сердце и β-адренорецепторы, оказывая дополнительное антиаритмическое действие подобно β-блокаторам. За счет частичной блокады кальциевых каналов, амиодарон угнетает синоатриальный узел, вызывая брадикардию и атриовентрикулярный узел, угнетая проводимость в нём. Во время инфаркта миокарда в ишемизированных участках возникает стойкая деполяризация кардиомиоцитов. При этом закрываются натриевые каналы, поскольку они «работают» при потенциале покоя минус 90 мВ. Если потенциал покоя в волокнах Пуркинье повышается до минус 70 мВ, активируются медленные кальциевые каналы. Их потенциал действия становится похожим на узловой. Блокаторы натриевых каналов в этом случае не работают. При аритмиях связанных с «медленным патологическим кальциевым потенциалом» эффективен амиодарон и блокаторы кальциевых каналов. Однако применение амиодарона ограничивается как множественными сердечными (декомпенсация сердечной недостаточности, атриовентрикулярная блокада) так и внесердечными побочными эффектами: нарушение функции щитовидной железы (содержит йод), развитие фиброзирующего альвеолита, отложение препарата в роговице, парестезии, тремор, фотосенсибилизация (окрашивание кожи в голубой цвет под влиянием солнечных лучей).
Группа IV. Блокаторы кальциевых каналов
Роль ионов кальция в организме разнообразна. Они принимают участие в экзо- и эндокринной секреции, агрегации тромбоцитов, сокращении гладкой и поперечнополосатой мускулатуре, в том числе и сердечной. В норме, проводящей системе сердца кальций принимает участие в генерации потенциала действия узлов: синоатриального и атриовентрикулярного. Он ответственен за медленную диастолическую деполяризацию и фазу быстрой деполяризации. Частота сердечных сокращений и скорость атриовентрикулярной проводимости зависят от степени активности кальциевых каналов в узлах. В цитозоле клетки концентрация Ca+, как и Na+ невелика. Основное его депо — саркоплазматический ретикулум (СПР). Когда ионы Ca+ входят в клетку, они, как уже упоминалось, вызывают деполяризацию цитоплазматической мембраны (ЦПМ) кардиомиоцитов. Инвагинации ЦПМ контактируют с мебраной СПР, вызывая её деполяризацию и выход ионов Ca+ в цитозоль. Кальций активирует актино-миозиновый комплекс, приводя к сокращению кардиомиоцитов. При ишемии миокарда и падении мембранного потенциала в кардиомиоцитах желудочков и волокон Пуркинье менее 60 мВ, в них начинает генерироваться медленный патологический кальциевый потенциал, сопровождающийся кальций-зависимыми желудочковыми аритмиями.

Кальциевые каналы делятся на 2 типа:
- Рецепторзависимые (например,α1-адренорецепторы)
- Потенциалзависимые:
- P-тип
- N-тип
- T-тип
- L-тип
Блокаторы кальциевых каналов (БКК), применяющиеся для лечения аритмий, влияют на L-тип каналов. Он имеется не только в клетках сердца, но и сосудов. Поэтому практически все БКК в той или иной степени снижают артериальное давление.
| Характеристика | Фенилалкиламины (верапамил,[11] галлопамил) | Бензотиазепины (дилтиазем) | Дигидропиридины (нифедипин, исрадипин, амлодипин) | Дифенилпиперазины (циннаризин, флуннаризин) |
|---|---|---|---|---|
| Влияние на сердце | ↑↑↑ | ↑↑ | 0 | 0 |
| Влияние на сосуды | ↑ (в том числе на коронарные) | ↑↑ (в том числе на коронарные) | ↑↑↑ | ↑↑↑ (преимущественно на мозговые) |
| Антиаритмический эффект | ↑↑↑ | ↑↑ | 0 | 0 |
| Показания | Наджелудочковые аритмии, ИБС | Наджелудочковые аритмии, ИБС | ИБС, артериальная гипертония, нарушения мозгового кровообращения, лёгочная гипертония | Нарушения мозгового кровообращения |
При аритмиях используются представители только первых двух групп: фенилалкиламины (верапамил, галлопамил) и бензотиазепины (дилтиазем). БКК используется для лечения наджелудочковых аритмий: синусовой тахикардии (оказывает отрицательное хронотропное действие), наджелудочковой пароксизмальной тахикардии, мерцательной аритмии и др. Эта группа снижает возбудимость узлов и межпредсердных путей быстрого проведения, тормозя фазу 0 и фазу 3 (Рис. 12). На атриовентрикулярный узел БКК оказывают отрицательное дромотропное и батмотропное действие. Увеличивая ЭРП узла, они частично блокируют проведение импульсов из предсердий в желудочки и переводят тахисистолическую форму в эусистолическую. Но кальциевые антагонисты противопоказаны при синдромах Вольфа-Паркинсона-Уайта и Клерка-Леви-Кристеско, так как замедляя узловую проводимость, они могут провоцировать развитие реципроктной пароксизмальной тахикардии: импульс быстрее достигает атриовентрикулярного узла антидромно. На рабочий миокард БКК оказывают отрицательное инотропное действие, которое компенсируется снижением ОПСС, поэтому сердечный выброс меняется назначительно. В целом, БКК хорошо переносятся и обладают низкой аритмогенностью.
| Подгруппа | Автоматизм синоатриального узла | Автоматизм и проводимость атриовентрикулярного узла | Эффективный рефрактерный период узлов | Эффективный рефрактерный период волокон Пуркинье |
|---|---|---|---|---|
| Фенилалкиламины | ↓↓ | ↓↓ | ↑↑ | 0 |
| Бензотиазепины | ↓ | ↓ | ↑ | 0 |
| Дигидропиридины | 0 | 0 | 0 | 0 |
Группа V. Прочие средства
Это препараты, имеющие механизм действия, отличный от лекарств из групп I—IV, поэтому некоторые авторы объединяют их в V группе .[12] Эта группа является собирательной и включает в себя вещества, оказывающие на миокард самое разнообразное воздействие.
Препараты калия
Препараты калия обладают слабо выраженным антиаритмическим действием. Применяются в основном при аритмиях, вызванных гипокалиемией при различных состояниях (например, при гиперальдостеронизме), а также при передозировке сердечных гликозидов. Ионы калия, поступающие в кровь с помощью Na+/K+-АТФ-азы активно транспортируются а клетки, в том числе, кардиомиоциты. Поскольку Na+/K+-АТФ-аза является магний-зависимой, оральные препараты калия сочетают с магнием (напр., панангин и аспаркам). Препараты калия способствуют повышению мембранного потенциала и снижают возбудимость и автоматизм миокарда. Внутривенно K+ и Mg2+ вводятся нередко в составе так называемых поляризующих смесей (инсулин+глюкоза+калий+магний). Инсулин способствует переходу глюкозы из плазмы в клетку вместе с ионами K+. Название эти смеси получили благодаря восстановлению мембранного потенциала, то есть, повышению поляризации кардиомиоцитов.
Аденозин
Аденозин является эндогенным антиаритмиком.[13] Воздействуя на в А1 аденозиновый рецептор, он угнетает аденилатциклазу и снижает концентрацию циклического АМФ, то есть, оказывает эффект, противоположный β-адреномиметикам и метилксантинам. Он открывает калиевые каналы и вызывает гиперполяризацию клеток, что приводит к снижению их автоматизма и проводимости. Однако сокращение эффективного рефрактерного периода может привести к повышению возбудимости и аритмиям.
Применяют аденозин в основном пр наджелудочковых и узловых тахиаритмиях, включая аритмии re-entry. В некоторых случаях аденозином может быть купирована предсердная тахикардия.
Благодаря рецепторзависимой активации калиевых каналов, аденозин вызывает укорочение рефракторного периода миокарда предсердий. Это является нежелательным эффектом, поскольку может вызвать фибрилляцию предсердий, особенно при внутривенном введении. У людей с дополнительными проводящими каналами фибрилляция предсердий может привести к фибрилляции желудочков.
Тахикардия в предсердиях или желудочках, не затрагивающая атриовентрикулярный узел, обычно не прекращается после введения аденозина, однако, благодаря замедлению атриовентрикулярной проводимости, он может вызвать временное снижение скорости ответа желудочков. При внутривенном введении аденозин вызывает временную полную атриовентрикулярную блокаду.
При использовании аденозина в качестве средства для купирования аритмии нормальным эффектом считается желудочковая асистолия в течение нескольких секунд. Такой эффект может дезориентировать пациента, находящегося в сознании, и связан с неприятными ощущениями в груди.
Сульфат магния
Механизм действия сульфата магния, предположительно, связан активацией фермента Na+/K+-АТФ-азы и калиевых каналов. Сульфат магния считается препаратом выбора для купирования приступа особой желудочковой тахикардии, называемой «пируэт» (torsade de pointes).[14][15][16] Её еще именуют веретенообразно двунаправленной желудочковой тахикардией. Она нередко возникает на фоне удлинения интервала QT. При этой форме комплексы QRS непрерывно меняются по форме, направлению, амплитуде и длительности: как бы «пляшут» вокруг изолинии. Удлинение интервала QT может быть вызвано электролитными нарушениями (прежде всего гипокалиемией и гипомагниемией), приемом антиаритмических препаратов класса Ia и Ic, а также некоторых препаратов, удлинняющих интервал QT: терфенадина, астемизола, фенотиазинов, трициклических антидепрессантов. Тахикардия «пируэт» может также возникать при питании жидкой белковой диетой. Нередко такие заболевания, как инсульт, брадиаритмии (особенно АВ-блокадой с проведением 2:1) могут осложняться веретенообразно двунаправленной желудочковой тахикардией. Также эта тахикардия может быть идиопатической.
Сердечные гликозиды
Сердечные гликозиды, оказывая выраженное положительное инотропное действие, усиливают систолический выброс. В результате активируются барорецепторы сердца (кардио-кардиальный рефлекс), дуги аорты и сонного клубочка (барорецептроный депрессорный рефлекс). По афферентным ветвям блуждающего нерва импульсы достигают ядра одиночного пути (солитарный тракт, солитарный пучок), возбуждая его. Далее по афферентным волокнам блуждающего нерва импульсы устремляются к заднему ядру блуждающего нерва (nucleus dorsalis nervi vagi). В результате возбуждаются эфферентные парасимпатические волокна блуждающего нерва, иннервирующие сердце. Следствием этого являются снижение частоты сердечных сокращений и затруднение атриовентрикулярной проводимости. Последнее свойство нередко используется для лечения сердечной недостаточности, осложнённой мерцательной аритмией: восстановление сократительной способности миокарда сопровождается нормализацией частоты сердечных сокращений. Однако пульс остаётся аритмичным. Сердечные гликозиды устраняют тахикардию также за счет снижения давления в устьях полых вен, устраняя рефлекс Бейнбриджа, связанный с активацией симпатической нервной системой
Средства, применяющиеся при блокадах сердца
Из блокад наиболее часто наблюдаются внутрижелудочковые. Блокада одной из ножек пучка Гиса лечения не требуют. Блокада двух ветвей с замедлением атриоветрикулярной проводимости требует установки кардиостимулятора. При нарушениях внутрипредсердной проводимости лечения также обычно не требуется: поскольку импульс распространяется в них как по трем пучкам, так и диффузно по рабочему миокарду предсердий, полная блокада здесь встречается редко. В клинической практике наиболее опасно нарушение атриовентрикулярной проводимости. Атриовентрикулярное соединение — самое узкое место в проводящей системе. При его поражениях возможно как замедление атриовентрикулярной проводимости, так и полное прекращение проведения с развитием полной поперечной блокады сердца. При последней единственным способом лечения является установка кардиостимулятора. В случае же неполной блокады в качестве паллиативной терапии могут назначаться следующие средства:
- β-адреномиметики (изадрин, орципреналин)
- М-холиноблокаторы (атропин, скополамин, платифиллин)
- Симпатомиметики (эфедрин) из-за меньшей эффективности и большого количества побочных эффектов (гипертонический криз, бессонница, лекарственная зависимость) В настоящее время не применяются
Эти средства, повышая возбудимость проводящей системы сердца, способствуют ускорению проведения в ней импульса.
М-холиноблокаторы устраняют эффекты блуждающего нерва, тонус которого значительно повышается при нижнем инфаркте миокарда, а также при операциях на органах желудочно-кишечного тракта. Ацетилхолин, выделяющийся из эфферентных окончаний блуждающего нерва, открывает рецепторзависимые калиевые каналы и вызывает гиперполяризацию клеток синоатриального и атриовентрикулярного узлов. Следствием этого являются отрицательный хроно-, батмо- и дромотропный эффекты. Атропин и скопаламин устраняют эти эффекты. Атропин обладает небольшой терапевтической широтой и при передозировке может вызвать тахикардию, сухость слизистых, задержку мочи, особенно у лиц с доброкачественной гиперплазией предстательной железы, а также психические нарушения. Побочные эффекты значительно меньше выражены у скополамина и практически отсутствуют у платифиллина.
β-адреномиметики оказывают действие, полностью противоположное М-холиноблокаторам. Они, взаимодействуя с β1-адренорецепторами, активируют аденилатциклазу и повышают внутриклеточную концентрацию цАМФ. Это сопровождается активацией кальциевых каналов клеток узлов и проявляется положительным хроно-, дромо- и батмотропным эффектами. β-адреномиметики повышают автоматизм и облегчают атриовентрикулярную проводимость. Наиболее опасные побочные эффекты — это аритмии. Также β-адреномиметики повышают уровень глюкозы и жиров в крови, вызывают тремор скелетных мышц. В этой связи их можно применять в очень ограниченный промежуток времени.
Примечания
- Unless else specified in boxes, then ref is: Rang, H. P. Pharmacology (неопр.). — Edinburgh: Churchill Livingstone, 1995. — ISBN 0-443-07145-4.
- Kulmatycki K. M., Abouchehade K., Sattari S., Jamali F. Drug-disease interactions: reduced beta-adrenergic and potassium channel antagonist activities of sotalol in the presence of acute and chronic inflammatory conditions in the rat (англ.) // Br. J. Pharmacol. : journal. — 2001. — May (vol. 133, no. 2). — P. 286—294. — doi:10.1038/sj.bjp.0704067. — PMID 11350865.
- E. A. I. Aidu, V. G. Trunov, L. I. Titomir. Biophysical Model for Beat-to-Beat Variations of Vectorcardiogram (англ.) // MEASUREMENT SCIENCE REVIEW : journal. — 2009. — Vol. 99, no. 3. — P. 64—66.
- Е. И. Чазов, Г. Г. Арабидзе, Ю. И. Бредикис, Н. В. Верещагин, А. И. Кириенко, Н. А. Мазур, Н. М. Мухарлямов. Болезни сердца и сосудов, том 3,стр, 5-11, 1992 г.
- Allessie M. A., Bonke F. I., Schopman F. J. Circus movement in rabbit atrial muscle as a mechanism of tachycardia. II. The role of nonuniform recovery of excitability in the occurrence of unidirectional block, as studied with multiple microelectrodes (англ.) // Circ. Res. : journal. — 1976. — August (vol. 39, no. 2). — P. 168—177. — PMID 939001.
- Фомина И. Г., Логунова Л. В., Кулешов Н. П., Маркова З. С., Евграфов О. В. Наследование синдрома Вольфа—Паркинсона—Уайта и эволюция его клинических проявлений в семьях больных при проспективном наблюдении. Клиническая медицина, 2001. 79(3):26-30. ISSN 0023-2149
- americanheart.org > Atrial and Ventricular Depolarization Changes Last updated 11/24/2008.
- Milne J. R., Hellestrand K. J., Bexton R. S., Burnett P. J., Debbas N. M., Camm A. J. Class 1 antiarrhythmic drugs--characteristic electrocardiographic differences when assessed by atrial and ventricular pacing (англ.) // Eur. Heart J. : journal. — 1984. — February (vol. 5, no. 2). — P. 99—107. — PMID 6723689.
- Trevor, Anthony J.; Katzung, Bertram G. Pharmacology (неопр.). — New York: Lange Medical Books/McGraw-Hill, Medical Publishing Division, 2003. — С. 43. — ISBN 0-07-139930-5.
- Lenz TL, Hilleman DE, Department of Cardiology, Creighton University, Omaha, Nebraska. Dofetilide, a New Class III Antiarrhythmic Agent. Pharmacotherapy 20(7):776-786, 2000. (Medline abstract)
- verapamil, Calan, Verelan, Verelan PM, Isoptin, Covera-HS. MedicineNet.com. Дата обращения: 6 октября 2011. Архивировано 11 августа 2012 года.
- Fogoros, Richard N. Electrophysiologic testing (неопр.). — Oxford: Blackwell Science, 1999. — С. 27. — ISBN 0-632-04325-3.
- Conti J. B., Belardinelli L., Utterback D. B., Curtis A. B. Endogenous adenosine is an antiarrhythmic agent (англ.) // Circulation. — Lippincott Williams & Wilkins, 1995. — March (vol. 91, no. 6). — P. 1761—1767. — PMID 7882485. (недоступная ссылка)
- Brugada P. Magnesium: an antiarrhythmic drug, but only against very specific arrhythmias (англ.) // Eur. Heart J. : journal. — 2000. — July (vol. 21, no. 14). — P. 1116. — doi:10.1053/euhj.2000.2142. — PMID 10924290.
- Hoshino K., Ogawa K., Hishitani T., Isobe T., Eto Y. Optimal administration dosage of magnesium sulfate for torsades de pointes in children with long QT syndrome (англ.) // J Am Coll Nutr : journal. — 2004. — October (vol. 23, no. 5). — P. 497S—500S. — PMID 15466950. Архивировано 13 января 2013 года.
- Hoshino K., Ogawa K., Hishitani T., Isobe T., Etoh Y. Successful uses of magnesium sulfate for torsades de pointes in children with long QT syndrome (англ.) // Pediatr Int : journal. — 2006. — April (vol. 48, no. 2). — P. 112—117. — doi:10.1111/j.1442-200X.2006.02177.x. — PMID 16635167. Архивировано 15 декабря 2019 года.
Литература
1. В.Г Кукес. Клиническая фармакология. — 3. — Москва: Геостар-Медиа, 2006. — С. 312—365. — 944 с. — ISBN 5-9704-0287-7.
2. А. Б де Луна. Руководство по клинической ЭКГ = Textbook of clinical electro cardiography / перевод с англ. М. Р. Кравченко, под ред. проф. Р. З. Амирова. — Москва: "Медицина", 1993. — С. 19—52, 329—366, 465—614. — 704 с. — 8000 экз. экз.