3-гидрокси-3-метилглютарил-кофермент А редуктаза
3-гидрокси-3-метилглютарил-кофермент А редуктаза (англ. HMG-CoA reductase, 3-hydroxy-3-methyl-glutaryl-CoA reductase, HMGR) — фермент (КФ 1.1.1.88), катализирующий синтез мевалоновой кислоты, лимитирующую стадию метаболического пути синтеза холестерина и других изопреноидов. Данный фермент является мишенью лекарств, снижающих уровень холестерина (статинов). Редуктаза гидроксиметилглютарил кофермента А заякорена в мембранах эндоплазматического ретикулума и имеет семь трансмембранных доменов, активный центр располагается на длинном С-концевом домене, со стороны цитозоля. По некоторым данным, фермент содержит восемь трансмембранных доменов.[1]
| 3-гидрокси-3-метил-глютарил-кофермент А редуктаза | |
|---|---|
 HMG-CoA редуктаза | |
| Обозначения | |
| Символы | HMGCR |
| Entrez Gene | 3156 |
| HGNC | 5006 |
| OMIM | 142910 |
| RefSeq | NM_000859 |
| UniProt | P04035 |
| Другие данные | |
| Шифр КФ | 1.1.1.88 |
| Локус | 5-я хр. , 5q13.3 -q14 |
| гидроксиметилглютарил-CoA редуктаза (NADPH-зависимая) | |
|---|---|
| Обозначения | |
| CAS | 9028-35-7 |
| UniProt | P04035 |
| Другие данные | |
| Шифр КФ | 1.1.1.34 |
| гидроксиметилглютарил-CoA редуктаза (NADH-зависимая) | |
|---|---|
| Обозначения | |
| CAS | 37250-24-1 |
| UniProt | P04035 |
| Другие данные | |
| Шифр КФ | 1.1.1.88 |
Шифр фермента для NAPDH-зависимого фермента КФ 1.1.1.34 и КФ 1.1.1.88 для NADH-зависимого.
У человека ген HMGR располагается на длинном плече пятой хромосомы (5q13.3-14).[2] Соответствующие ферменты животных, растений и бактерий выполняют сходную функцию.
Реакция
3-гидрокси-3-метилглютарил-кофермент А редуктаза катализирует реакцию превращения 3-гидрокси-3-метил-глютарил-кофермента А в мевалоновую кислоту:
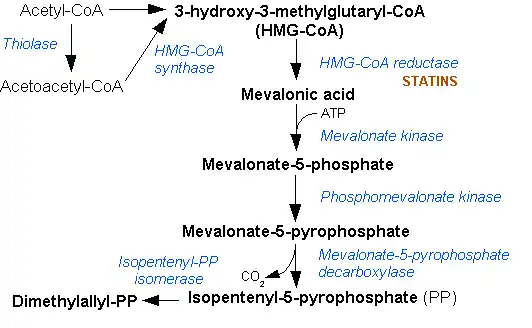 |
Ингибиторы
Лекарства
Лекарственные препараты, ингибирующие 3-гидрокси-3-метилглютарил-кофермент А редуктазу, называют статинами (гиполипидемическими препаратами). Статины используют для снижения уровня холестерина в крови, для профилактики сердечно-сосудистых заболеваний, а также для терапии аутоиммунных заболеваний (ревматоидный артрит в сочетании с умеренными дозами болезньмодифицирующих препаратов).[3]
Коммерчески доступны следующие статины: розувастатин (CRESTOR), ловастатин (Mevacor), аторвастатин (Lipitor), правастатин (Pravachol), флювастатин (Lescol), питавастатин (Livalo), and симвастатин (Zocor).[4] Экстракт красных рисовых дрожжей содержит несколько природных статинов, снижающих уровни холестерина - монаколины. Наиболее известен монаколин К — ловастатин (торговая марка мевакор)[5]
Лекарственный препарат выторин содержит симвастатин и эзетимиб и обладает двумя эффектами — снижение и синтеза холестерина, и всасывания холестерина в кишечнике.[6]
Гормоны
3-гидрокси-3-метилглютарил-кофермент А редуктаза активна при высоком уровне глюкозы в крови. Ферменты инсулин и глюкагон поддерживают гомеостаз глюкозы в крови, и, таким образом, опосредованно контролируют активность HMGR. Снижение активности фермента вызывается АМР-зависимой протеинкиназой, чувствительной к уровню АМР и лептина.
Значение
HMG-CoA редуктаза является трансмембранным белком и катализирует ключевую стадию в синтезе мевалоновой кислоты, которая является предшественником стеролов, изопреноидов и других липидов. У человека HMG-CoA редуктаза катализирует ключевую стадию синтеза холестерина и представляет является основной мишенью лекарственных препаратов, снижающих уровень холестерина.
Гидроксиметилглютарил-СоА редуктаза не только участвует в синтезе холестерина, но и обладает также другими эффектами.[7] Показаны противовоспалительные эффекты статинов,[8] которые, по-видимому, являются ограничивают синтез изопреноидов, необходимых для воспалительных процессов. Показано, что блокирование синтеза изопреноидов статинами благотворно влияет на протекание рассеянного склероза (воспалительное аутоиммунное заболевание) на мышиных моделях.[9]
HMG-CoA редуктаза является также важным ферментом в биологии развития. Ингибирование её активности привоидит к нарушениям морфологическим дефектам у zebrafish.[10]
Регуляция
Регуляция фермента осуществляется на разных стадиях: транскрипция, трансляция, деградация, фосфорилирование.
Транскрипция
Транскрипция гена редуктазы усиливается белком, связывающимся с регуляторным элементом стерола (англ. SREBP, sterol regulatory element binding protein). SREBP связывается с регуляторным элементом стерола (англ. SRE), который находится на 5'-конце гена редуктазы. Когда SREBP неактивен, он связан с эндоплазматическим ретикулумом или с ядерной мембраной. Когда уровень холестерина снижается, SREBP диссоциирует от мембраны путём протеолиза и переносится в ядро клетки, где связывается с SRE и усиливает транскрипцию. При повышении уровня холестерина, протеолитическое отщепление SREBP от мембран прекращается, а белки в ядре подвергаются деградации.
Трансляция
Трансляция мРНК ингибируется производным мевалоновой кислоты, возможно, фарнезолом.[11][12][13]
Деградация редуктазы
Повышение уровня стеролов усиливает деградацию редуктазы на эндоплазматическом ретикулуме, а также её протеолиз. Спирали 2-6 трансмембранного домена редуктазы HMG-CoA улавливают повышение концентрации холестерина, что приводит к открытию остатка лизина-248, который далее убиквитинилируется лигазой Е3 и служит сигналом для протеолиза.
Фосфорилирование
Краткосрочное ингибирование HMG-CoA редуктазы достигается путём фосфорилирования (по остатку серина 872, у человека).[14] Редуктаза HMG-CoA фосфорилируется и инактивируется АМР-зависимой протеинкиназой, которая фосфорилирует и инактивирует ацетилкофермент А карбоксилазу, лимитирующую биосинтез жирных кислот.[15] Оба пути использования ацетил-СоА для синтеза липидов инактивируются при уменьшении запасов энергии и повышении концентрации АМР.[16]
Показано, что LKB1 является киназой АМР киназы,[17] которая принимает участие в передаче сигнала с участием ионов кальция и кальмодулина. Этот путь передает сигнал от лептина, адипонектина и других сигнальных молекул.[16]
Примечания
- Roitelman J., Olender E.H., Bar-Nun S., Dunn W.A., Simoni R.D. Immunological evidence for eight spans in the membrane domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase: implications for enzyme degradation in the endoplasmic reticulum (англ.) // Journal of Cell Biology : journal. — 1992. — June (vol. 117, no. 5). — P. 959—973. — doi:10.1083/jcb.117.5.959. — PMID 1374417.
- Lindgren V., Luskey K.L., Russell D.W., Francke U. Human genes involved in cholesterol metabolism: chromosomal mapping of the loci for the low density lipoprotein receptor and 3-hydroxy-3-methylglutaryl-coenzyme A reductase with cDNA probes (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1985. — December (vol. 82, no. 24). — P. 8567—8571. — doi:10.1073/pnas.82.24.8567. — PMID 3866240.
- Farmer J.A. Aggressive lipid therapy in the statin era (англ.) // Progress in Cardiovascular Diseases : journal. — 1998. — Vol. 41, no. 2. — P. 71—94. — doi:10.1016/S0033-0620(98)80006-6. — PMID 9790411.
- Is there a "best" statin drug? (неопр.) // Johns Hopkins Med Lett Health After 50. — 2004. — January (т. 15, № 11). — С. 4—5. — PMID 14983817.
- Lin Y.L., Wang T.H., Lee M.H., Su N.W. Biologically active components and nutraceuticals in the Monascus-fermented rice: a review (англ.) // Applied Microbiology and Biotechnology : journal. — Springer, 2008. — January (vol. 77, no. 5). — P. 965—973. — doi:10.1007/s00253-007-1256-6. — PMID 18038131.
- Flores N.A. Ezetimibe + simvastatin (Merck/Schering-Plough) (неопр.) // Curr Opin Investig Drugs. — 2004. — September (т. 5, № 9). — С. 984—992. — PMID 15503655.
- Arnaud C., Veillard N.R., Mach F. Cholesterol-independent effects of statins in inflammation, immunomodulation and atherosclerosis (англ.) // Curr Drug Targets Cardiovasc Haematol Disord : journal. — 2005. — April (vol. 5, no. 2). — P. 127—134. — doi:10.2174/1568006043586198. — PMID 15853754.
- Sorrentino S., Landmesser U. Nonlipid-lowering effects of statins (неопр.) // Curr Treat Options Cardiovasc Med. — 2005. — December (т. 7, № 6). — С. 459—466. — doi:10.1007/s11936-005-0031-1. — PMID 16283973.
- Stüve O., Youssef S., Steinman L., Zamvil S.S. Statins as potential therapeutic agents in neuroinflammatory disorders (англ.) // Current Opinion in Neurology : journal. — Lippincott Williams & Wilkins, 2003. — June (vol. 16, no. 3). — P. 393—401. — doi:10.1097/01.wco.0000073942.19076.d1. — PMID 12858078.
- Thorpe J.L., Doitsidou M., Ho S.Y., Raz E., Farber S.A. Germ cell migration in zebrafish is dependent on HMGCoA reductase activity and prenylation (англ.) // Developmental Cell : journal. — 2004. — February (vol. 6, no. 2). — P. 295—302. — doi:10.1016/S1534-5807(04)00032-2. — PMID 14960282.
- Meigs T.E., Roseman D.S., Simoni R.D. Regulation of 3-hydroxy-3-methylglutaryl-coenzyme A reductase degradation by the nonsterol mevalonate metabolite farnesol in vivo (англ.) // Journal of Biological Chemistry : journal. — 1996. — April (vol. 271, no. 14). — P. 7916—7922. — doi:10.1074/jbc.271.14.7916. — PMID 8626470.
- Meigs T.E., Simoni R.D. Farnesol as a regulator of HMG-CoA reductase degradation: characterization and role of farnesyl pyrophosphatase (англ.) // Archives of Biochemistry and Biophysics : journal. — Elsevier, 1997. — September (vol. 345, no. 1). — P. 1—9. — doi:10.1006/abbi.1997.0200. — PMID 9281305.
- Keller R.K., Zhao Z., Chambers C., Ness G.C. Farnesol is not the nonsterol regulator mediating degradation of HMG-CoA reductase in rat liver (англ.) // Archives of Biochemistry and Biophysics : journal. — Elsevier, 1996. — April (vol. 328, no. 2). — P. 324—330. — doi:10.1006/abbi.1996.0180. — PMID 8645011.
- Istvan E.S., Palnitkar M., Buchanan S.K., Deisenhofer J. Crystal structure of the catalytic portion of human HMG-CoA reductase: insights into regulation of activity and catalysis (англ.) // The EMBO Journal : journal. — 2000. — March (vol. 19, no. 5). — P. 819—830. — doi:10.1093/emboj/19.5.819. — PMID 10698924.
- Goldstein J.L., Brown M.S. Regulation of the mevalonate pathway (англ.) // Nature. — 1990. — February (vol. 343, no. 6257). — P. 425—430. — doi:10.1038/343425a0. — PMID 1967820.
- Hardie D.G., Scott J.W., Pan D.A., Hudson E.R. Management of cellular energy by the AMP-activated protein kinase system (англ.) // FEBS Letters : journal. — 2003. — July (vol. 546, no. 1). — P. 113—120. — doi:10.1016/S0014-5793(03)00560-X. — PMID 12829246.
- Witters L.A., Kemp B.E., Means A.R. Chutes and Ladders: the search for protein kinases that act on AMPK (англ.) // Trends : journal. — 2006. — January (vol. 31, no. 1). — P. 13—6. — doi:10.1016/j.tibs.2005.11.009. — PMID 16356723.
Внешние ссылки
- Синтез холестерина с подробностями регуляции
