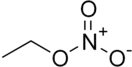Этилнитрат
Этилнитрат (ethyl nitrate, nitric ethyl ester, этилнитрат, этиловый эфир азотной кислоты) — C2H5ONO2, сложный эфир этанола и азотной кислоты, типичный представитель класса сложных эфиров. Применяется в органическом синтезе в качестве нитрующего агента, в том числе для получения лекарственных препаратов и красителей.
| Этилнитрат | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
ethyl nitrate, этилнитрат | ||
| Хим. формула | Брутто-формула (система Хилла) C2H5NO3 Формула в виде текста: C2H5ONO2 | ||
| Физические свойства | |||
| Состояние | жидкое | ||
| Молярная масса | 91.066 г/моль | ||
| Плотность | d204 = 1,1084 г/см3 [1], 1,1076 г/см3 [3] г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -94,6[1]°C, -102 [2] °C | ||
| • кипения | 87,2 °C[1] °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 1,335 3,0955 эт. сп.: эф. | ||
| Вращение | 1,385221,5 [1]° | ||
| Классификация | |||
| Рег. номер CAS | 625-58-1 | ||
| PubChem | 12259 | ||
| Рег. номер EINECS | 210-903-3 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 11756 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
Бесцветная, легко подвижная жидкость с приятным запахом, Тпл −94,6 °C[1], −102 °C[2], Ткип 87,2 °C[1], (74,35 °C (температура кипения азеотропа, давление 1 атм) вода 22% этилнитрат 78%) (61,77 °C (температура кипения азеотропа, давление 1 атм) метиловый спирт 57% этилнитрат 43%), d204 1,1084 г/см3 [1], 1,1076 г/см3 [3] n20D 1,3852[1] ΔHобр -499,5 ккал/кг [2]. Этилнитрат плохо растворяется в воде (1,3 г/100 мл при 35 °C и 3,09 г/100мл 55 °C) [вставить ссылку], хорошо в спирте и большинстве органических растворителей, образует азеотропные смеси (с 22% воды Ткип 74,35 °C, с 57% метилового спирта Ткип 61,77 °C) [вставить ссылку]
Химические свойства
В кислой и щелочной среде этилнитрат легко гидролизуется с образованием этилового спирта. В присутствии оснований этилнитрат способен нитровать амины, ароматические и алифатические соединения, содержащие активные СН2-группы, а также может выступать в качестве алкилирующего агента для аминов, сульфидов, азидов и некоторых других соединений [1,3]. Восстановление этилнитрата различными реагентами, такими как FeCl2, LiAlH4, N2H4 и некоторыми другими, приводит к образованию этанола с высокими выходами [3].
Физиологическое действие
Действие этилнитрата сходно с действием других эфиров азотной кислоты (Нитроглицерин, Эринит, мононитроизосорбид) и азотистой кислоты, как например амилнитрита. В организме расщепляется до NO, который катализирует выделение циклического гуанозинмонофосфата, являющегося вазодилататом, в результате чего Этилнитрат, как и остальные нитраты и нитриты, оказывает сосудорасширяющее действие, в основном на вены. Это приводит к головным болям и тахикардии у работающих с подобными веществами. Так же этилнитрат токсичен, способен окислять гемоглобин в метгемоглобин, вызывает головную боль, головокружение и учащенное сердцебиение [1,3].
Взрывчатые характеристики
Этилнитрат взрывоопасен, скорость детонации 5800 м/сек (при плотности 1,1 г/см3)[2]. Расширение в свинцовой бомбе 420 см3/10 г[2], 345мл [вставить ссылку], теплота взрыва (Н2Ож) 993 ккал/кг[2], в непрочной оболочке детонирует неустойчиво, в прочной оболочке (стальная труба диаметром 27 мм, толщина стенки 3 мм) устойчивая детонация возникает от промежуточного детонатора, содержащего 40 г ТЭНа [вставить ссылку]. Этилнитрат способен взрываться при контакте со щелочными металлами, легко образует взрывчатые смеси с воздухом при комнатной температуре нижний КПВ 3.8% [1,2].
Получение
1. 200г чистой азотной кислоты (1,4) кипятят с 2г азотнокислой мочевины, охлаждают и смешивают с 150г абсолютного спирта. После прибавления 50г азотнокислой мочевины отгоняют на водяной бане примерно 2/3 жидкости, в перегонную колбу по каплям приливают равный отогнанному объем смеси 4 частей азотной кислоты, прокипяченной с 1% мочевины, и 3 частей спирта. С помощью указанного количества мочевины можно получить 2-3кг этилнитрата. Продукт выделяют водой, сушат хлористым кальцием и перегоняют на водяной бане. Температура кипения 86 °C [4]
Источники
- «Химический энциклопедический словарь» М. «Советская энциклопедия» 1983
- «Explosives» Fifth Ed. 2002 Wiley-VCH Verlag GmbH & Co.KGaA
- «Химическая энциклопедия в пяти томах» Т.3. Изд. «Большая Российская энциклопедия» 1992.
- Губен И. «Методы органической химии» Т. III. Вып. 1. М-Л., Госхимиздат 1934.
- Губен И. «Методы органической химии» Т. IV. Вып. 1. книга первая. М-Л., Госхимиздат. 1949
- G. Hetherington and R. L. Robinson "Nitryl fluoride as a nitrating agent". J. Chem. Soc. 1954, 3512.