Никотиновый ацетилхолиновый рецептор
Никотиновый ацетилхолиновый рецептор (никотиночувствительный холинорецептор, н-холинорецептор, (англ. nACh-receptor)) — подвид ацетилхолиновых рецепторов, который обеспечивает передачу нервного импульса через синапсы и активируется ацетилхолином, а также никотином. Этот рецептор вместе с ГАМКA-, ГАМКC- глициновым и 5-HT3-рецепторами образует семейство лиганд-зависимых ионных каналов с цистеиновой петлёй.
Общая характеристика
Данный рецептор найден в химических синапсах как в центральной, так и в периферической нервной системе, в нервно-мышечных синапсах, а также в эпителиальных клетках многих видов животных.
Никотиновый ацетилхолиновый рецептор был открыт в начале XX века, как «рецепторная структура никотина», приблизительно за 25-30 лет до того, как была исследованная его роль в проведении нервных сигналов, генерируемых с помощью ацетилхолина. При попадании ацетилхолина на молекулу данного рецептора приоткрывается проницаемый для катионов канал, что приводит к деполяризации клеточной мембраны и генерации нервного импульса в нейроне или сокращению мышечного волокна (в случае нервно-мышечного синапса).
Структура
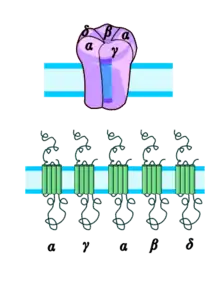
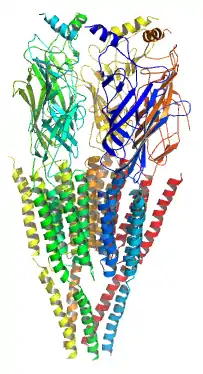
Высокая концентрация никотиновых ацетилхолиновых рецепторов в электрических органах некоторых скатов, в частности у калифорнийского гнюса и мраморного электрического ската, вместе с выделением α-бунгаротоксина (αBGT — полипептида из яда южнокитайского многополосого крайта, который является необратимым лигандом и специфическим антагонистом ацетилхолина для никотиновых рецепторов в нервно-мышечных синапсах), позволила биохимически очистить и детально исследовать никотиновые ацетилхолиновые рецепторы, а также идентифицировать место связывания ацетилхолина. Было доказано, что данный рецептор является гетероолигомерным комплексом, состоящим из четырех разных белковых субъединиц, которые были названы соответственно их молекулярной массе (в килодальтонах): α (40), β (50), γ (60), δ (65). При естественной экспрессии в клетке сначала возникают димерные комплексы α-γ и α-δ, потом формируется тример α-β-δ, и наконец, после объединения димера и тримера, в клеточную мембрану встраивается функциональный пентамер со стехиометрией α2βγδ.
Основное место связывания агониста ацетилхолина расположено на внешне-клеточной поверхности каждой из α-субъединиц, рядом с сегментом М1, и окружено двумя соседними остатками цистеина (номера 192 и 193 в первичной структуре); для формирования функционального места связывания, данные цистеиновые остатки должны быть объединены дисульфидным мостиком между входящими в их состав атомами серы. Также для связывания ацетилхолина важным (но не всегда критическим) фактором является наличие в данном месте остатков тирозина и триптофана. Место связывания ацетилхолина сформировано тремя параллельными α-спиралями белковой молекулы, благодаря чему оно находится в углублении между ними. Для открытия ионного канала рецептора внешнеклеточный домен на α-субъединице, расположенный в районе остатка Lys-125 на расстоянии около 10 Ангстрем от места связывания ацетилхолина, распознается не ацетилхолином, а эндогенным серотонином, а также особым классом агонистов — производных физостигмина. Регион близ остатка Lys-125 и соседние части рецепторной макромолекулы, которые включают дисульфидный мостик (Cys128-Cys142), являются очень похожими во всех субъединицах никотиновых рецепторов. Учитывая то, что β-, γ- и δ-субъединицы лишены агонист-связывающего места, они называются «структурными» субъединицами.
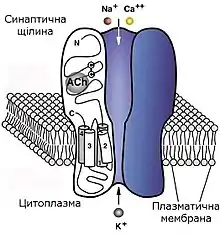
Трансмембранная часть рецептора образует ионный канал, стенки которого сформированы сегментами М2 всех пяти субъединиц. Было доказано, что относительно небольшие пертурбации, а именно поворот на 4° двух агонист-связывающих субъединиц, приводят к значительному смещению сегментов М2 и открытию поры ионного канала, что является условием возникновения катионного тока через рецептор.
Разновидности никотиновых рецепторов
| Разновидности никотиновых рецепторов и их фармакологические свойства | ||||
|---|---|---|---|---|
| Анатомическая локализация | Субъединичный состав | ACh-чувствительность (ЕС50) и кинетическая характеристики | Агонисты | Антагонисты |
| Электрические органы рыб | α12β1γδ | 0.3μM | Карбамоилхолин | (+)-тубокурарин |
| Мышечная система рыб | α12β1εδ | - | Анатоксин | α-бунгаротоксин |
| ЦНС | α7 | 120μM, быстрая десенситизация | Производные анабазина | α-бунгаротоксин, метилликаконитин |
| Автономные ганглии ЦНС | α4β2 | 0.3μM, медленная десенсетизация | Эпибатидин, никотин, n-этилкарбамоилхолин | дигидро-β-эритроидин, κ-бунгаротоксин |
| ЦНС | α3β4 | 0.1μM, медленная десенсетизация | Ацетилхолин | Мекамиламин |
| Кератиноциты | α3β2 | 0.1μM | Ацетилхолин, анатоксин, никотин | Мекамиламин, κ-бунгаротоксин |
Физиология и фармакология
Электрофизиологическая характеристика никотиновых рецепторов мышечной ткани впервые была дана благодаря внутриклеточному отводу электрических потенциалов; кроме того, никотиновый рецептор был одним из первых, на которые удалось записать электрические токи, которые проходят через единичный рецепторный канал. Используя последний подход удалось доказать, что ионный канал данного рецептора существует в дискретных открытом и закрытом состояниях. В открытом состоянии рецептор может пропускать ионы Na+, К+ и, в меньшей мере, двухвалентные катионы; проводимость ионного канала при этом является постоянной величиной. Тем не менее, время существования канала в открытом состоянии является характеристикой, которая зависит от напряжения приложенного к рецептору потенциала, при этом рецептор стабилизируется в открытом состоянии при переходе от малых значений напряжения (деполяризация мембраны) к большим (гиперполяризация). Долгодействующая аппликация ацетилхолина и других агонистов рецептора приводит к снижению его чувствительности к рецепторной молекуле и увеличению времени пребывания ионного канала в закрытом состоянии — то есть у никотинового рецептора наблюдается явление десенсетизации.
Классической характеристикой никотиновых рецепторов в нервных ганглиях и в головном мозге является холинергический ответ на электрическое раздражение, которое блокируется дигидро-β-эритроидином; кроме того, для этих рецепторов характерное высокоафинное связывание с тритий-меченным никотином. αBGT-чувствительные рецепторы в нейронах гиппокампа характеризуются низкой чувствительностью к ацетилхолину, в отличие от αBGT-нечувствительных рецепторов. Селективным и оборотным конкурентным антагонистом αBGT-чувствительных рецепторов является метилликаконитин, а некоторые производные анабезиина вызывают селективное активационное влияние на эту группу рецепторов. Проводимость ионного канала αBGT-чувствительных рецепторов является довольно высокой (73pS); также они имеют относительно высокую проводимость ионов кальция, сравнительно с ионами цезия. Данный рецептор обладает необыкновенными вольт-зависимыми свойствами: обще-клеточный ток, записанный в физиологическом состоянии, при наложении деполяризационных величин электрического потенциала указывает на достоверное уменьшение прохождение ионов через ионные каналы; это явление регулируется концентрацией в растворе ионов Mg2+. Для сравнения, никотиновые рецепторы на мышечных клетках не претерпевают никаких изменений ионного тока при изменении значений мембранного электрического потенциала, а N-метил-D-аспартатный рецептор, который также обладает высокой относительной проницаемостью для ионов Са2+ (PCa/PCs 10.1), даёт обратную картину изменения ионных токов в ответ на смену электрического потенциала и наличие ионов магния: при повышении электрического потенциала до гиперполяризующих величин и повышении концентрации ионов Mg2+ ионный ток через данный рецептор блокируется.
Другое важное свойство αBGT-чувствительных нейрональных никотиновых рецепторов — это их реакция на стимуляцию. Экспозиция высоких концентраций ацетилхолина приводит к очень быстрой десенсетизации ответа отдельного канала и быстрого падения электрического ответа всей клетки. Повторная экспозиция коротких импульсов ацетилхолина также приводит к уменьшению максимальной амплитуды рецепторного ответа. При этом энергетический подкорм клетки высокоэнергоёмкими молекулами (АТФ, фосфокреатин, креатинкиназа) или промежуточными продуктами их метаболизма способен предотвратить такое уменьшение. Почти все аспекты функционирования αBGT-чувствительных никотиновых рецепторов, включая эффективность агонистов, кооперативные эффекты, а также фракционирование по активности и десенсетизация, регулируются внеклеточной концентрацией Са2+. Такая регуляция может быть особенно важной в случаях, когда рецепторы расположены на дендритах.
В дополнение к селективной активации рецепторов ацетилхолинподобными агонистами, все подтипы никотиновых рецепторов активируются производными физостигмина; тем не менее, такая активация свойственна только низкочастотным токам единичных рецепторов, которые не могут быть приглушены антагонистами ацетилхолина. Недавние исследования доказывают, что активность никотиновых рецепторов, полученная с помощью ацетилхолина или других агонистов, может положительно модулироваться производными физостигмина, которые связываются со своим специфическим местом на рецепторной молекуле. Возможным считается наличие эндогенного лиганда данного места, и наиболее вероятным кандидатом на эту роль считают 5-гидрокситриптамин.
Нейроанатомия и патология
Роль периферийных никотиновых рецепторов освещается при аутоиммунных заболеваниях, при которых поражаются отдельные формы рецепторов. У пациентов, которые болеют миастенией, антитела к мышечным никотиновым рецепторам предотвращают нормальное функционирование мышц, приводя к общему ослаблению последних (первичный симптомом данного заболевания).
В ЦНС дисфункция никотиновых ацетилхолиновых рецепторов в гиппокампе и коре больших полушарий приводит к возникновению болезни Альцгеймера.
Токсикология
Токсины, способные подавлять функционирование никотиновых рецепторов, найдены во многих представителях растительного и животного царств. Специфическим блокатором никотиновых ацетилхолиновых рецепторов является α-анатоксин, синтезируемый синезелёными водорослями вида Anabaena flosaquae. Эти водоросли, активно размножающиеся в пресных водоемах в периоды их "цветения", высокотоксичны для многих гидробионтов (включая рыб) и могут приводить к их массовой гибели. Некоторые растительные яды, содержащие вещества, способные поражать никотиновые рецепторы (тубокурарин, физостигмин, метилликаконитин и др.), издревле используются дикими племенами для войн и охоты. Из представителей животного царства ядами подобного действия обладают некоторые змеи (α-бунгаротоксин) и лягушки (гистрионикотоксин). Среди неорганических веществ специфическими блокаторами этого вида рецепторов являются соли свинца, чем в значительной степени и объясняются их нейротоксические эффекты.
В открытом состоянии никотиновые рецепторы мышечного типа блокируются большим количеством специфических лигандов — блокираторов ионного канала. К ним относятся местные анестетики (бупивакаин, пиперокаин, лидокаин), антимускариновые соединения (атропин, скополамин), антагонисты с наркотическим эффектом (налтрексон), специфические токсины (гистрионикотоксин), антивирусные вещества и антибиотики (амантадин, квинакрин), стимуляторы (никотин), психотропные вещества (кокаин), и фосфорорганические соединения (ДФФ, ТЭПФ, зарин, VX). Несмотря на разную химическую природу, эти агенты-блокираторы представляют собой в большинстве случаев молекулы, положительно заряженные на большей части поверхности. Учитывая то, что место, связывание с которым обеспечивает блокирование ионного канала, является чувствительным к заряду клеточной мембраны, действие блокираторов этого канала является также электрозависимым; при гиперполяризационных значениях заряда мембраны блокирования происходит наиболее активно.
См. также
Примечания
Литература
Albuquerque EX, Pereira EFR, Castro NG, Alkondon M, Reinhardt S, Schröder G, Maelicke A (1995): Nicotinic receptor function in the mammalian central nervous system. Ann NY Acad Sci volume: 757 1995 pp 47–72
Alkondon M, Albuquerque EX (1993): Diversity of nicotinic acetylcholine receptors in rat hippocampal neurons. I. Pharmacological and functional evidence for distinct structural subtypes. J Pharmacol Exp Ther volume: 265 pp 1455–1473
Lena C, Changeux J–P (1993): Allosteric modulations of the nicotinic acetylcholine receptor. Trends Neurol Sci volume: 16 pp 181–186
McGehee DS, Role LW (1995): Physiological diversity of nicotinic acetylcholine receptors expressed by vertebrate neurons. Annu Rev Physiol volume: 57 pp 521–546
Pereira E, Reinhardt–Maelicke S, Schrattenholz A, Maelicke A, Albuquerque EX (1993): Identification and functional characterization of a new agonist site on nicotinic acetylcholine receptors of cultured hippocampal neurons. J Pharmacol Exp Therap volume: 265 1993 pp 1474–1491
Schrattenholz A, Pereira EFR, Roth U, Weber K–H, Albuquerque EX, Maelicke A (1996): Agonist responses of neuronal nicotinic acetylcholine receptors are potentiated by a novel class of allosterically acting ligands. Mol Pharmacol volume: 49 pp 1–6
Wonnacott S, Dasdo A, Sanderson E, Rowell P (1990): Presynaptic nicotinic receptors and the modulation of transmitter release. The Biology of Nicotine Dependence, Ciba Found Symp 152 pp 87–105 publisher: Wiley Chichester