Тетраэтилпирофосфат
Тетраэтилпирофосфат, тетраэтилдифосфат, также тетраэтиловый эфир пирофосфорной кислоты (сокр. ТЭПФ) — фосфорорганическое соединение, сложный эфир, чрезвычайно токсичное вещество, обладает необычайно сильным контактным инсектицидным воздействием, относится к группе тетраалкилдифосфатам. Токсичность ТЭПФ, как и многих других ФОС обусловлена необратимым ингибированием фермента ацетилхолинэстеразы, а также некоторых сериновых протеаз (химотрипсин и другие), в крайне низких концентрациях (10-5—10-8 М и менее), вызывая патофизиологические эффекты со стороны ЦНС (судороги, кинетозы, спазмы, параличи, нарушения сознания, кому), сердечно-сосудистой (брадикардия, резкое падение артериального давления, коллапс), пищеварительной систем (слюнотечение, рвоту, диспептические явления итд.), дыхательной (бронхоспазм), и как следствие летальный исход. Вследствие этих негативных свойств имеет запрет на производство и применение в России.
| Тетраэтилпирофосфат | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
Тетраэтилдифосфат |
| Сокращения | ТЭПФ |
| Традиционные названия | Тетраэтилпирофосфат |
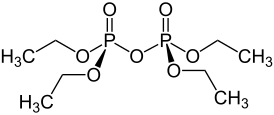
| Хим. формула | C8H20O7P2 |
| Рац. формула | [C2H5O]4P2O3 |
| Физические свойства | |
| Состояние | бесцветная гигроскопичная жидкость |
| Молярная масса | 290,19 г/моль |
| Плотность | 1,189 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 0 °C |
| • кипения | 124 °C |
| Давление пара | 0,0002 ± 0,0001 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления | 1,4071 |
| Классификация | |
| Рег. номер CAS | 107-49-3 |
| PubChem | 7873 |
| Рег. номер EINECS | 203-495-3 |
| SMILES | |
| InChI | |
| RTECS | UX6825000 |
| ChEBI | 82149 |
| Номер ООН | 3018 |
| ChemSpider | 7585 |
| Безопасность | |
| ЛД50 | 0,5 мг/кг (крысы, перорально) |
| Токсичность | Чрезвычайно токсичен, сильнейший яд нервно-паралитического воздействия. |
| Пиктограммы ECB |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физико-химические свойства
Представляет собой бесцветную или слегка желтоватую (технический препарат) легкоподвижную жидкость, с приятным запахом, хорошо растворимую в воде, также растворяется в органических растворителях: в бензоле, толуоле, тетрахлорметане, ацетоне, этаноле, плохо растворяется в лигроине и петролейном эфире. Ввиду высокой гигроскопичности ТЭПФ неустойчивое соединение и быстро гидролизуется (~7 ч при 25 °С) до низкотоксичных продуктов (диэтилфосфорная кислота). При нагревании свыше 170 °С ТЭПФ разлагается, а при температуре свыше 208 °С происходит бурное выделение этилена[2].
Получение
ТЭПФ был одним из первых синтезированных ФОС. Впервые синтез осуществлён Мошниным в 1850 году, в лаборатории Ш. Вюрца (Париж). В 1854 году Ф. Клермонт синтезировал эфир из серебряной соли пирофосфорной кислоты и йодистого этила по схеме[3]:
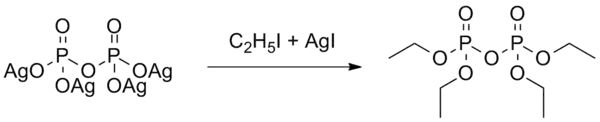 .
.
В СССР впервые синтез ТЭПФ произведен в химическом институте Казанского филиала АН СССР А.Е. Арбузовым в 1931 году.
Применение
Ввиду чрезвычайно высокой токсичности ТЭПФ применение ограничено, в настоящее время его используют в качестве инсектицидных смесей с другими ФОС. Как боевое отравляющее вещество ТЭПФ не может быть использовано, вследствие низкой устойчивости и быстрому гидролизу (оно практически неэффективно во влажном климате).
Эффективность как пестицида
ТЭПФ является одним из первых фосфорорганических инсектицидов и акарицидов с чрезвычайно сильным контактным воздействием (даже в ничтожных концентрациях — 0,02% и менее вызывал полную гибель тли и клещей), более сильным, чем никотин. Несмотря на это, ТЭПФ не оказывает системного воздействия, то есть не распространяется по организму насекомого. ТЭПФ можно использовать в качестве эффективного фумиганта (препарат находится в форме аэрозоля). Растения, опрыскиваемые ТЭПФ через сутки становятся безопасными, так как он полностью гидролизуется.
Технический препарат, содержащий до 40% ТЭПФ называют бладан. Впервые использован как инсектицид в 1943 году в Германии.
Синонимы и торговые названия
- Бладан (продукт компании «Фарбенфабрике Байер», ФРГ),
- Вапотон (California spray-chemical Co, США),
- Киллакс,
- Мортопал,
- Нифос Т (Монсанто, США),
- Тетрон (American Potash and Chemical Company, CША).
Токсикология и безопасность
ТЭПФ типичный представитель фосфорорганических соединений с ярко выраженным антихолинэстеразным воздействием.
Молекулярный механизм действия ТЭПФ
Действие молекул ТЭПФ на активный центр холинэстеразы, как и всех сериновых протеаз основан на связывании серина и образования с ним ковалентно прочного тераэтилсеринпирофосфата, который очень слабо гидролизуется, тем самым изменяет конформацию фермента, приводя его в неактивную форму. Инактивация сериновых протеаз ТЭПФ наблюдается даже в крайне низких концентрациях.
Токсичность
ТЭПФ чрезвычайно токсичное вещество. ЛД50 даны в таблице.
| Организм | ЛД50 в мг/кг |
|---|---|
| Крысы | 0,5-1,7 (перорально) |
| Мыши | 5-7 (внутрибрюшинно) |
| Кролики | 6-7 (накожно) |
| Кошки | 1,2-3 (накожно) |
| Человек | 0,7-1 (перорально) <0,4 (аэрозоль) |
Смертельная доза для человека при пероральном поступлении ТЭПФ составляет порядка 40—70 мг. Наибольший токсический эффект развивается при вдыхании паров или аэрозоля ТЭПФ. ЛД100 при респираторном пути проникновения снижается до 15—30 мг.
Основные пути проникновения ТЭПФ в организм человека — респираторный (дыхательный), пероральный или контактный (накожный). Признаки отравления могут возникнуть в течение нескольких минут. Признаками отравления служат резкое увеличение потовыделения, миоз (сужение зрачков), слюнотечение, головокружение, снижение мышечной активности (миастения), гипотония, брадикардия, поражение зрения, судороги, диспептические явления, тошнота, рвота, понос, бронхоспазм в случае вдыхании аэрозоля или паров. При высоких дозах (40—70 мг) происходит почти мгновенное поражение ЦНС, потеря сознания, конвульсии или параличи, как следствие кома, возможен летальный исход в течение нескольких часов, в случае отправления аэрозолем или парами, содержащие ТЭПФ вероятность летального исхода намного выше и смерть может наступить в течение нескольких минут.
Эффективными антидотами (реактиваторы холинэстеразы) при отравлении ТЭПФ служат атропин и 2-ПАМ (пралидоксим).
Безопасность
ТЭПФ относится к веществам с очень высокой опасностью (I класс опасности). В России данное вещество запрещено в производстве и применении. В США ПДК составляет 0,05 мг/м3.
Примечания
- http://www.cdc.gov/niosh/npg/npgd0590.html
- Шрадер Г. Новые фосфорорганические инсектициды / Перевод с немецкого А. Г. Зенькевич, канд. хим. наук Я. А. Мандельваума, канд. хим. наук К. Д. Швецовой-Шиловской, Под редакцией доктора хим. маук, проф. Н. Н. Мельникова. — 2-е изд. — М.: МИР, 1965.
- Fest, Christa; Schmidt, Karl-Julius. The Chemistry of Organophosphorus Pesticides - Springer (англ.). — doi:10.1007/978-3-642-68441-8.