Меламин
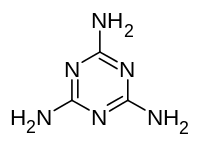
Мелами́н (1,3,5-триазин-2,4,6-триамин) — бесцветные кристаллы, малорастворимые в воде. Объём мирового производства в 2007 году составил более 1 млн тонн.
| Меламин | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
1,3,5-триазин-2,4,6-триамин |
| Традиционные названия | Меламин; 2,4,6-триамино-симм-триазин, цианурамид, циануротриамид, циануротриамин |
| Хим. формула | C3H6N6 |
| Рац. формула | C3H6N6 |
| Физические свойства | |
| Молярная масса | 126,12 г/моль |
| Плотность | 1,574 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 345 °C (разл.) |
| Химические свойства | |
| Растворимость | |
| • в воде при 20 °C | 0,31 г/100 мл |
| Классификация | |
| Рег. номер CAS | 108-78-1 |
| PubChem | 7955 |
| Рег. номер EINECS | 203-615-4 |
| SMILES | |
| InChI | |
| ChEBI | 27915 |
| ChemSpider | 7667 |
| Безопасность | |
| ЛД50 | 3248 мг/кг (крысы, перорально)[1] |
| Токсичность | малотоксичен для млекопитающих[2] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства и синтез
Плавится при 364 °C, с разложением; растворим в воде (0,5 % по массе при 20 °C, 4 % при 90 °C), нерастворим в органических растворителях. Меламин — основание, с кислотами образует соли (C3H6N6×HCl и др.), разлагающиеся при нагревании. В жидком аммиаке с амидами щелочных металлов меламин образует как продукты присоединения C3H6N6·MNH2 так и соли, M3C3H3N6 (M — металл).
При нагревании до 354 °С и выше меламин отщепляет аммиак с образованием мелема (2,6,10-триамино-сим-гептазина).
Характерным свойством меламина является замещение аминогрупп под действием нуклеофилов. Так, в водных растворах щелочей при повышенных температурах и давлениях меламин гидролизуется, отщепляя аммиак, при этом происходит последовательное замещение аминогрупп на гидроксильные группы с образованием аммелина (2-гидрокси-4,6-диамино-сим-триазина), аммелида (2,4-дигидрокси-6-амино-сим-триазина) и циануровой кислоты (2,4,6-тригидрокси-сим-триазина). Под действием алкиламинов или их солей аминогруппы меламина замещаются аминоалкильными группами с образованием N-алкилмеламинов, степень замещения (от одного до трёх) определяется степенью избытка амина.
Под действием электрофильных агентов происходит замещение атомов водорода аминогрупп меламина: нитрование азотной кислотой в уксусной кислоте ведёт к образованию моно- и ди-N-нитромеламинов. Галогенирование ведёт к образованию N-галогенмеламинов различной степени замещения, при хлорировании может быть получен гексахлормеламин, являющийся энергичным хлорирующим агентом и применяющийся в составе композиций для дегазации отравляющих веществ.
В лабораторных условиях простейшим методом синтеза меламина является взаимодействие цианурхлорида с аммиаком при 100 °C, другими методами являются синтезы меламина нагреванием гуанидина и тримеризацией цианамида.
В промышленности применяется два основных метода синтеза меламина — пиролиз мочевины и синтез из дициандиамида.
При пиролизе мочевины применяются катализаторы (на основе Al2O3 и др.) при 350—450 °C и давлении 50—200 МПа, при этом на первой стадии мочевина отщепляет аммиак с образованием циановой кислоты:
- (NH2)2CO → HCNO + NH3
которая затем с отщеплением углекислого газа образует меламин:
- 6 HCNO → C3H6N6 + 3 CO2
Другим методом является синтез из дициандиамида (NH2CN)2 в жидком аммиаке или растворе аммиака в этаноле при температуре 180—500 °C и давлении 4—20 МПа (40—200 кг/см²). Исторически первым промышленным методом стало производство меламина из дициандиамида, получаемого, в свою очередь, из карбида кальция, однако по мере роста крупнотоннажного производства мочевины дициандиамидный процесс был вытеснен процессом пиролиза мочевины.
Обнаружение
Для обнаружения используется хроматография. Гравиметрически меламин определяют в виде солей с циануровой или пикриновой кислотой, а также фотометрически в слабокислой среде по поглощению при длине волны 236 нм.
Производство в России
25 мая 2012 года в Невинномысске (Ставропольский край) на ОАО «Невинномысский Азот» была запущена первая в России установка по производству меламина и был получен первый отечественный меламин. Годовой объём производства составляет 50 тысяч тонн[3].
В Татарстане на базе ОЭЗ «Алабуга» планируется запуск завода по производству 120 тысяч тонн меламина в год[4].
Применение
Меламин широко применяется в промышленном органическом синтезе, в том числе ионообменных смол, дубителей, гексахлормеламина, используемого в производстве красителей и гербицидов. Меламин, наряду c мочевиной, также применялся в качестве небелкового источника азота для домашнего скота, однако в 1978 году был сделан вывод о «неприемлемости меламина как небелкового источника азота, так как он медленнее и недостаточно полно гидролизуется по сравнению с другими — например, мочевиной».
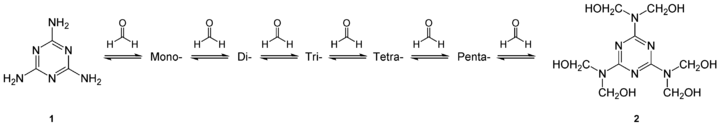
Большая часть производимого меламина используется в производстве меламин-формальдегидных смол, относимых к группе аминопластов, которые получают поликонденсацией меламина с формальдегидом в слабощелочной среде (рН 7,8—8,5), при этом на начальной стадии происходит гидроксиметилирование меламина по аминогруппам, с образованием метилольных производных различной степени замещения (вплоть до гексаметилолмеламина):
Гидроксиметилированные производные далее реагируют со свободными аминогруппами меламина и метилолмеламинов с образованием метиленовых мостиков. В результате образуются термореактивные олигомеры при нагревании либо в присутствии каталитических количеств кислот.
Меламин-формальдегидные смолы применяются как в составе полимерных композиций (клеи, лаки), в качестве связующего полимера для пресс-композиций с различными наполнителями (целлюлоза, стекловолокно, древесная мука) и в качестве пластификаторов бетона, так и в качестве конструкционного материала для производства готовых изделий и пенопластов (вспененный меламин).
Токсичность и «меламиновые скандалы»

Меламин слаботоксичен: медианная летальная доза при пероральном введении у крыс составляет 3,16 г/кг, то есть меламин не более ядовит, чем поваренная соль (LD50 3 г/кг[5]). В соответствии с данными, опубликованными Международной программой химической безопасности, меламин не метаболизируется и быстро выводится с мочой, генотоксичность в испытаниях in vivo не выявлена, не оказывает раздражающего действия на кожу (при испытаниях на кроликах и морских свинках) и слизистую глаза (при испытаниях на кроликах). Канцерогенные свойства при испытаниях на мышах не выявлены. Вместе с тем, по данным UNEP (1998 год), у самцов крыс при длительном (36—105 недель) приёме пищи, содержащей сверхвысокие концентрации меламина (0,45—3 %), может возникать рак мочевого пузыря[2].
В списке химических веществ, выделяющихся из материалов, контактирующих с пищевыми продуктами, допустимые количества миграции (ДКМ) которых регламентируются в РФ, меламин отсутствует, для пищевой посуды из меламин-формальдегидных смол в этом списке определено только ДКМ формальдегида[6].
Меламин использовался некоторыми недобросовестными производителями при производстве пищевых продуктов для повышения измеряемой при анализе концентрации белка: при анализе методами Кьельдаля и Дюма содержание белка измеряется по содержанию азота.
В июне 2008 года китайская компания Sanlu Group, производящая сухое молоко, получила претензии потребителей, что у младенцев, которых кормили произведённым компанией молоком, были обнаружены камни в почках. Дальнейшее расследование показало, что в сухом молоке этой и ряда других компаний присутствует меламин. Скандал получил широкое освещение в средствах массовой информации, в результате чего за период до конца 2008 года в Китае по поводу проблем мочевыделительной системы, включая подозрения на камни в почках, были госпитализированы 51 тыс. младенцев и детей младшего возраста, были зафиксированы шесть смертельных случаев.
Всемирной организацией здравоохранения и Продовольственной и сельскохозяйственной организацией ООН была организована совместная экспертная группа по токсикологии меламина и циануровой кислоты, которая повторно рассмотрела данные по токсикологии меламина и подтвердила, что как острая, так и хроническая токсичность меламина весьма малы: меламин практически не метаболизируется и выводится из организма с мочой. Вместе с тем при высоких концентрациях меламина в пище может происходить кристаллизация меламина в моче, проявляющаяся в кристаллурии и при очень высоких концентрациях ведущая к образованию камней в почках[7].
ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест» определяют для меламина № 502: класс опасности — 2, ПДК максимальная разовая 0,02 мг/м³, ПДК среднесуточная 0,01 мг/м³.
- Отравление домашних животных кормом с меламином
В начале 2007 года 2200 собак и 1950 кошек в США погибли из-за отказа почек. Причиной стало употребление корма, изготовленного крупнейшим в Северной Америке производителем сухих и влажных кормов для животных компанией Menu Foods Inc. (Онтарио, Канада) для более чем 100 брендов (среди них Procter & Gamble)[8][9].
Procter & Gamble единственная установила причину — наличие меламина в зерновом глютене китайского происхождения — и опубликовала токсикологическую информацию. По сообщению USA Today, компания Procter & Gamble заверила в усилении контроля над компанией-производителем[10].
Примечания
- Melamine MSDS Архивная копия от 13 октября 2010 на Wayback Machine.
- Melamine // OECD SIDS (недоступная ссылка). Дата обращения: 6 февраля 2011. Архивировано 1 октября 2008 года.
- Виктория Ханова. Первый меламиновый игрок. expert.ru (22 июля 2013).
- У Инцинь: "Инвестиционный климат Татарстана много лет подряд является одним из лучших в России". sntat.ru. Дата обращения: 25 июля 2021.
- Safety data for sodium chloride // MSDS (недоступная ссылка). Дата обращения: 6 февраля 2011. Архивировано 2 декабря 2011 года.
- Гигиенические нормативы ГН 2.3.3.972-00 «2.3.3. Гигиена питания. Тара, посуда, упаковка, оборудование и другие виды продукции, контактирующие с пищевыми продуктами. Предельно допустимые количества химических веществ, выделяющихся из материалов, контактирующих с пищевыми продуктами».
- Expert meeting to review toxicological aspects of melamine and cyanuric acid, 1—4 December 2008 (недоступная ссылка). WHO. Дата обращения: 13 июня 2013. Архивировано 13 июня 2013 года.
- Tainted pet food fund approved // UPI.com.
- Gerald F. Davis, Marina V.N. Whitman, & Mayer N. Zald (Winter 2008). “The Responsibility Paradox”. Stanford Social Innovation Review. 6 (1). ISSN 1542-7099. Архивировано из оригинала 2021-05-16. Дата обращения 2021-05-16. Используется устаревший параметр
|deadlink=(справка) - Melamine, San Francisco Chronicle, 22.10.2008. (недоступная ссылка). Дата обращения: 23 октября 2009. Архивировано 23 марта 2010 года.