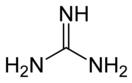
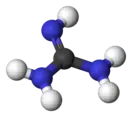
Гуанидин
Гуанидин — бесцветное кристаллическое вещество, расплывается на воздухе вследствие поглощения влаги. Сильное однокислотное основание pKa=12.5 . С HCl, HNO3 образует устойчивые соли.
| Питанауанидин | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | гуанидин | ||
| Хим. формула | CH5N3 | ||
| Рац. формула | CH5N3 | ||
| Физические свойства | |||
| Состояние | твёрдое в-во | ||
| Молярная масса | 59.07 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 50 °C | ||
| Энтальпия | |||
| • образования | -56,01 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 113-00-8 | ||
| PubChem | 3520 | ||
| Рег. номер EINECS | 204-021-8 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 42820 | ||
| ChemSpider | 3400 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
История
Находится в моче как продукт нормального метаболизма белков. Вещество было впервые синтезировано окислительной деградацией природных ароматических продуктов, гуанина, выделенного из перуанского гуано [1]. Несмотря на простоту строения молекулы, кристаллическая структура была впервые описана на 148 лет позже открытия.[2].
Свойства
Легко алкилируется. Обладает фунгицидной и бактерицидной активностью.
Получение
- В промышленности гуанидины получают сплавлением солей аммония с мочевиной или циангуанидином,
- NH4NO3 + 2(NH2)2CO → (NH2)2C=NH*HNO3 + CO2 + 2NH3
- а также гидрогенолизом циангуанидина на никеле Ренея:
- NH2-C(=NH)-NH-CN → [H2, Ni] NH2-C(NH)-NH2
- Извлекают при помощи ионообменных смол из отходов производства мочевины.
- Карбонат извлекают из отходов производства меламина
- Другие соли получают по реакции с основанием гуанидина
- Спиртовые растворы при реакции хлорида гуанидиния с соответствующими алкоголятами
Протонирование и основность
Гуанидин благодаря резонансной делокализации заряда в симметричном гуанидиниевом катионе, образующимся при протонировании гуанидина, является сильным основанием, сравнимым по силе (рКа = 13,5) с гидроксидом натрия.
Высокая основность характерна и для замещенных гуанидинов: так, гуанидиновая группа аминокислоты аргинина (pKa 12.48) протонирована в физиологических условиях (при pH < 10).
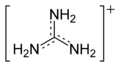
резонансная структура 
канонические формы
Гуанидинхлорид используют для денатурации белков. Причём концентрация и свободная энергия раскрытия находятся в линейной зависимости. С этой же целью используется и тиоцианат гуанидиния.
Производные гуанидина
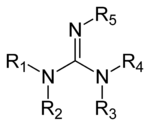
Гуанидины — группа органических соединений с общей структурой (R1R2N)(R3R4N)C=N-R5. Центральная связь внутри этой структуры — иминовая; другая распознаваемая субструктура — аминаль. Примеры гуанидинов: аргинин, триазобициклодецен и сакситоксин. Другие производные могут включать гуанидин гидроксид. Гуанидиновые соли хорошо известны благодаря их денатурирующему действию на белки. Гуанидин хлорид наиболее известный денатурант. В его 6 М растворе практически все белки с упорядоченой структурой теряют свою упорядоченность.
Бигуаниды — гипогликемические лекарственные средства, используемые при сахарном диабете. Молекулы бигуанидов состоят из полиметиленовой цепочки и гуанидиновой группы на обеих её концах.
Применение
- Соли гуанидина, применяют в промышленности:
- — динитрат — как взрывчатое вещество,
- — нитрат — в качестве монотоплива
- — фосфат — в текстильной промышленности для придания огнеупорных свойств тканям,
- — карбонат — в синтезе поверхностно-активных веществ и косметике для выпрямления волос
- Продукт конденсации гуанидина с формальдегидом используется как ионообменная смола.
- Он также применяется в производстве пластмасс.
- В качестве перспективного альтернативного топлива [3]
- Нитрогуанидин, нитрат гуанидиния, перхлорат гуанидиния используют в качестве ракетного топлива.
- Хромат — ингибитор коррозии
Безопасность
Токсичен, вызывает при попадании на кожу и в дыхательные пути щелочной ожог.
Примечания
- A. Strecker, Liebigs Ann. Chem. 1861, 118, 151.
- T. Yamada, X. Liu, U. Englert, H. Yamane, R. Dronskowski, Chem. Eur. J. 2009, 15, 5651.
- European Patent Office application EP20050746871 (недоступная ссылка)