Кардиолипин
Кардиолипин — фосфолипид, который является важным компонентом внутренней мембраны митохондрий, липидный состав которой включает около 20 % кардиолипина[1]. Кардиолипин во внутренней мембране митохондрий клеток млекопитающих и растительных клеток[2][3] необходим для функционирования многочисленных ферментов, участвующих в энергетическом обмене. Кардиолипин также встречается в мембранах бактерий.[4]
| Кардиолипин | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
1,3-бис-(sn-3’-фосфатидил)-sn-глицерол |
| Хим. формула | C81H158O17P2 |
| Физические свойства | |
| Молярная масса | 1466.058544 г/моль |
| Классификация | |
| ChEBI | 28494 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Происхождение названия «кардиолипин» связано с открытием этого соединения: впервые кардиолипин был выделен из мышечной ткани сердца быка в начале 1940-х годов.[5]
В зарубежной биохимической литературе для кардиолипина используют сокращение «CL».
Структура
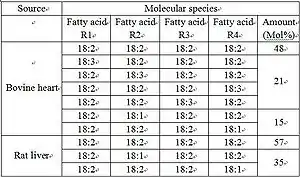
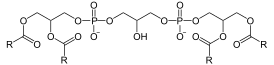
Кардиолипин представляет собой дифосфатидилглицерол: два фосфатидилглицерола соединены с глицеролом, формируя димерную структуру. Таким образом, кардиолипин имеет четыре хвоста жирных кислот и два остатка ортофосфорной кислоты. Четыре алкильных группы кардиолипина открывают широкие возможности для разнообразия. Однако в большинстве животных тканей кардиолипин содержит C18-цепи с двумя ненасыщенными связями в каждой из них.[6] Возможно, (18:2)-4 конфигурация радикальных групп является важным структурным требованием для высокой аффинности кардиолипина к белкам внутренней мембраны митохондрий млекопитающих[7], хотя, согласно некоторым исследованиям, важность этой конфигурации зависит от рассматриваемого белка.[8]
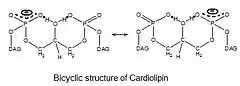
Каждый из фосфатов кардиолипина может связать один протон. При этом ионизация одного фосфата происходит при значении pH, сильно отличном от кислотности среды, при которой ионизуются обе фосфатные группы: pK1 = 3, pK2 > 7.5.[9] Поэтому при нормальных физиологических условиях (значение pH примерно равно 7) кардиолипин несёт только один отрицательный элементарный заряд. Гидроксильные группы (-OH and -O-) фосфатов образуют при этом внутримолекулярные водородные связи с центральной гидроксильной группой глицерола, формируя бициклическую резонансную структуру. Эта структура связывает один протон, который затем используется при окислительном фосфорилировании. Такая бициклическая структура «головки» кардиолипина очень компактна, и «головка» этого фосфолипида мала относительно большого «хвоста», состоящего из четырёх длинных цепей.
Метаболизм
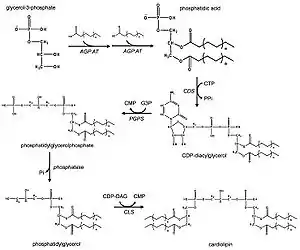
Метаболический путь у эукариот
Кардиолипин образуется из фосфатидилглицерола(PG), который в свою очередь синтезируется из CDP-диацилглицерола(CDP-DAG ) и глицерол-3-фосфата(G3P)[10].
У дрожжей, растений и животных процесс синтеза кардиолипина, как считается, протекает в митохондриях. Первый этап — ацилирование глицерол-3-фосфата(G3P) ферментом глицерол-3-фосфат ацилтрансферазой(AGP-AT). Затем ацилглицерол-3-фосфат может быть повторно ацилирован этим же ферментом с образованием фосфатидной кислоты. Фермент CDP-DAG синтаза (фосфатидат цитидилтрансфераза) участвует в последующем превращении фосфатидной кислоты в цитидиндифосфат-диацилглицерол (CDP-DAG). Следующий этап процесса — присоединение G3P к CDP-DAG и превращение в фосфатидилглицеролфосфат (PGP) с участием фермента PGP синтазы(PGPS). Затем происходит дефосфорилирование (с помощью PTPMT1[11]) с образованием фосфатидилглицерола (PG). На последней стадии синтеза еще одна молекула CDP-DAG используется для связывания с PG, в результате чего и образуется молекула кардиолипина. Эта реакция катализируется ферментом кардиолипин синтазой (CLS), локализованной в митохондриях[2][3][12]..
Метаболический путь у прокариот
В бактериях дифосфатидилглицерол синтаза катализирует перенос фосфатидной группы одного фосфатидилглицерола на свободную 3’-гидроксильную группу другого. В некоторых физиологических условиях реакция может происходить в обратном направлении, в таком случае происходит расщепление кардиолипина.
Функции
Изменение структуры полимерных комплексов
Благодаря особенной бициклической структуре кардиолипина изменение pH и присутствие бивалентных катионов могут способствовать изменениям в его структуре. Для кардиолипина свойственно большое разнообразие различных форм образуемых им полимеров. Установлено, что наличие в присутствии Ca2+ или других бивалентных катионов у кардиолипина возможен переход из ламеллярной фазы в гексагональную (переход La-HII)[13]. Считается, что этот переход имеет непосредственную связь с процессом слияния мембран[14].
Участие в поддержании функционирования дыхательной цепи
Фермент цитохромоксидаза (комплекс IV дыхательной цепи) — большой трансмембранный белковый комплекс, обнаруженный в бактериях и митохондриях. Это последний из ферментов в цепи переноса электронов, расположенный в митохондриальной (бактериальной мембране). Комплекс IV катализирует перенос 4 электронов с 4 молекул цитохрома c на O2, в результате чего образуется две молекулы воды. Было показано, что для поддержания ферментативной активности комплекса IV необходимы 2 связанные с ним молекулы кардиолипина.
Для поддержания четвертичной структуры и функциональной активности цитохром-bc1-комплекса (комплекса III) также необходим кардиолипин.[15] АТФ-синтаза (комплекс V) также демонстрирует высокую аффинность к кардиолипину, связывая кардиолипин в соотношении 4 молекулы кардиолипина на одну молекулу комплекса V.[16]
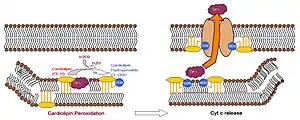
Участие в запуске апоптоза
Кардиолипин-специфичная оксигеназа катализирует образование гидроперекиси кардиолипина, что приводит к конформационным изменениям последнего. Осуществляющееся в результате этого перемещение кардиолипина на внешнюю мембрану митохондрии[17] способствует образованию поры, через которую может выходить цитохром c. Выход цитохрома c из межмембранного пространства митохондрии в цитозоль индуцирует процесс апоптоза.
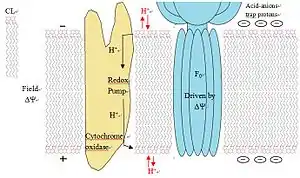
Протонная ловушка в окислительном фосфорилировании
В процессе окислительного фосфорилирования происходит перемещение протонов из матрикса митохондрии в межмембранное пространство, что обуславливает разницу в pH. Предполагается, что кардиолипин функционирует как протонная ловушка в митохондриальных мембранах, локализуя этот поток протонов и минимизируя тем самым изменения pH в межмебранном пространстве.
Эта функция объясняется особенностями структуры кардиолипина: захватывая протон, кардиолипин образует бициклическую структуру, которая несёт отрицательный заряд. Таким образом бициклическая структура может освобождать или связывать протоны для поддержания pH.[18]
Другие функции
- Транслокация холестерола с внешней на внутреннюю митохондриальную мембрану.
- Активация разрезания боковой цепи холестерина.
- Импорт белков в митохондриальный матрикс.
- Антикоагулянтная активность[19].
Клиническое значение
Болезни Альцгеймера и Паркинсона
Окислительный стресс и перекисное окисление липидов способствуют развитию потери нейронов и митохондриальной дисфункции в чёрной субстанции при развитии болезни Паркинсона, а также могут играть роль в патогенезе болезни Альцгеймера.[20][21] Как установлено, содержание кардиолипина в мозге уменьшается по мере старения[22], а последние исследования на мозге крысы показывают, что причиной этого является перекисное окисление липидов в митохондриях, подверженный окислительному стрессу. Согласно другому исследованию, биосинтез кардиолипина может быть ослаблен, приводя к восстановлению 20 % кардиолипина.[23] Наблюдается также связь с 15 % уменьшением функции комплексов I/III электрон-транспортной цепи, что считается ключевым фактором в развитии болезни Паркинсона.[24]
ВИЧ
Более 60 миллионов человек по всему миру заражены вирусом иммунодефицита человека. Гликопротеин вируса ВИЧ-1 (HIV-1) имеет по меньшей мере 4 сайта для нейтрализующих антител. Среди них мембранно-проксимальный участок особенно «привлекателен» как мишень для антител, так как он облегчает вход вируса в T-клетки и высоко консервативен в разных штаммах.[25] Однако обнаружено, что 2 антитела 2F5 и 4E10 в мембранно-проксимальном участке взаимодействуют с собственными антигенами (эпитопами), в том числе с кардиолипином.[26][27] Таким образом, затруднительно использовать такие антитела при вакцинации.[28]
Диабет
У людей, больных диабетом, сердечные приступы случаются в два раза чаще, чем у людей, не страдающих этим заболеванием. У диабетиков сердечно-сосудистая система поражается на раннем этапе заболевания, что часто заканчивается преждевременной смертью, делая сердечные заболевания основной причиной смерти людей, болеющих диабетом. Кардиолипин на ранних стадиях диабета находится в сердечной мышце в недостаточных количествах, что может быть вызвано липидо-разрушающим ферментом, который становится более активным при диабете[29].
Рак
Отто Генрих Варбург впервые предложил, что происхождение рака связано с необратимым повреждением клеточного дыхания в митохондриях, однако структурная основа такого повреждения оставалась неясной. Так как кардиолипин является важным фосфолипидом внутренней мембраны митохондрии и необходим для осуществления функции митохондрии, была предложена идея, что именно аномалии в структуре кардиолипина могут негативно сказываться на функции митохондрий и биоэнергетике. Недавнее исследование[30], которое проводилось на опухолях мозга мышей, показало, что основные аномалии во всех опухолях связаны именно со структурой кардиолипина или его содержанием.
Синдром Барта
В 2008 году доктор Кулик (Dr. Kulik) обнаружил, что все исследованные пациенты с Синдромом Барта имели нарушения в молекулах кардиолипина.[31] Синдром Барта — редкое генетическое заболевание, которое, как было установлено в 1970-е годы, может приводить к смерти в младенческом возрасте. Этот синдром обусловлен мутациями в гене TAZ, кодирующем тафазин — фермент (фосфолипид-лизофосфолипид трансацилазу), участвующий в биосинтезе кардиолипина. Этот фермент катализирует перенос линолевой кислоты с фосфатидилхолина на монолизокардиолипин и является необходимым для синтеза кардиолипина у эукариот.[32] Одним из результатов мутаций является неспособность митохондрий поддерживать необходимое производство АТФ. Ген тафазина у человека расположен в длинном плече X хромосомы (Xq28)[33], поэтому женщины-гетерозиготы не повержены синдрому Барта.
Примечания
- D. Nelson, M. Cox. Principles of Biochemistry, 5th Ed (2008). W. H. Freeman and Company.
- M. Nowicki and M. Frentzen. Cardiolipin synthase of Arabidopsis thaliana (англ.) // FEBS Letters : journal. — 2005. — Vol. 579, no. 10. — P. 2161—2165. — doi:10.1016/j.febslet.2005.03.007. — PMID 15811335.
- M. Nowicki. Characterization of the Cardiolipin Synthase from Arabidopsis thaliana (англ.) // Ph.D. thesis, RWTH-Aachen University : journal. — 2006. Архивировано 5 октября 2011 года.
- Michael Schlame. Glycerolipids. Cardiolipin synthesis for the assembly of bacterial and mitochondrial membranes (англ.) // the Journal of Lipid Research : journal. — 2008. — Vol. 49. — P. 1607—1620. — doi:10.1194/jlr.R700018-JLR200.
- Pangborn M. Isolation and purification of a serologically active phospholipid from beef heart (англ.) // J. Biol. Chem. : journal. — 1942. — Vol. 143. — P. 247—256.
- Michael SCHLAME, Stuart BRODY, Karl Y. HOSTETLER. Mitochondrial cardiolipin in diverse eukaryotes (англ.) // European Journal of Biochemistry : journal. — 1993. — March (vol. 212, no. 3). — P. 727—733. — doi:10.1111/j.1432-1033.1993.tb17711.x. (недоступная ссылка)
- Schlame M., Horvath L., Vigh L. Relationship between lipid saturation and lipid-protein interaction in liver mitochondria modified by catalytic hydrogenation with reference to cardiolipin molecular species (англ.) // Biochem. J. : journal. — 1994. — Vol. 265, no. 1. — P. 79—85. — PMID 2154183.
- Chicco A. J., Sparagna GC. Role of cardiolipin alterations in mitochondrial dysfunction and disease (англ.) // Am J Physiol Cell Physiol. : journal. — 2007. — Vol. 292, no. 1. — P. 33—44. — PMID 16899548.
- M Schlame, M Ren, Y Xu, ML Greenberg, I Haller. Molecular symmetry in mitochondrial cardiolipins (неопр.) // Chemistry and Physics of Lipids. — 2005. — Т. 138, № 1—2. — С. 38—49. — doi:10.1016/j.chemphyslip.2005.08.002. — PMID 16226238.
- Марри Р. и др. Биохимия человека в 2 томах. Москва 2004
- Zhang, J; Dixon J. E. Mitochondrial phosphatase PTPMT1 is essential for cardiolipin biosynthesis (англ.) // Cell Metab : journal. — 2011. — 6 June (vol. 13, no. 6). — P. 690—700. — doi:10.1016/j.cmet.2011.04.007. — PMID 21641550.
- R. H. Houtkooper and F. M. Vaz. Cardiolipin, the heart of mitochondrial metabolism (англ.) // Cell. Mol. Life Sci. : journal. — 2008. — Vol. 65, no. 16. — P. 2493—2506. — doi:10.1007/s00018-008-8030-5. — PMID 18425414.
- Antonio Ortiz, J. Antoinette Killian,Arie J. Verkleij,and Jan Wilschut. Membrane fusion and the lamellar-to-inverted-hexagonal phase transition in cardiolipin vesicle systems induced by divalent cations (англ.) // Biophysical Journal : journal. — 1999. — Vol. 77, no. 4. — P. 2003—2014. — doi:10.1016/S0006-3495(99)77041-4. — PMID 10512820.
- Some Methodological Developments in Phospholipid Chemistry & Physico-Chemical Studies of Calcium-ion Induced Changes in Cardiolipin Vesicles Архивная копия от 19 декабря 2013 на Wayback Machine
- Baltazar Gomez Jr. and Neal C. Robinson. Phospholipase Digestion of Bound Cardiolipin Reversibly Inactivates Bovine Cytochrome bc1 (англ.) // Biochemistry : journal. — 1999. — Vol. 38, no. 28. — P. 9031—9038. — doi:10.1021/bi990603r. — PMID 10413476.
- Eble K.S.,ColemanW.B.,Hantgan R. R. and CunninghamC. Tightly associated cardiolipin in the bovine heart mitochondrial ATP synthase as analyzed by 31P nuclear magnetic resonance spectroscopy (англ.) // J. Biol. Chem. : journal. — 1990. — Vol. 265, no. 32. — P. 19434—19440. — PMID 2147180.
- Kagan VE et al. Oxidative lipidomics of apoptosis: redox catalytic interactions of cytochrome c with cardiolipin and phosphatidylserine (англ.) // Free Radic Biol Med. : journal. — 2004. — Vol. 37, no. 12. — P. 1963—1985. — PMID 15544916.
- Thomas H. Haines and Norbert A. Dencher. Cardiolipin: a proton trap for oxidative phosphorylation (англ.) // FEBS Lett. : journal. — 2002. — Vol. 528, no. 1—3. — P. 35—39. — doi:10.1016/S0014-5793(02)03292-1. — PMID 12297275.
- Fernández J.A., Kojima K., Petäjä J., Hackeng T.M, Griffin J.H. Cardiolipin enhances protein C pathway anticoagulant activity (англ.) // Blood Cells Mol Dis. : journal. — 2000. — Vol. 26, no. 2. — P. 115—123. — PMID 10753602.
- Beal MF. Mitochondria, oxidative damage, and inflammation in Parkinson's disease (англ.) // Ann NY Acad Sci : journal. — 2003. — Vol. 991. — P. 120—131. — doi:10.1111/j.1749-6632.2003.tb07470.x. — PMID 12846981.
- Jenner P. Oxidative stress as a cause of Parkinson's disease (неопр.) // Acta Neurol Scand Suppl. — 1991. — Т. 136. — С. 6—15. — doi:10.1002/ana.10483. — PMID 12666096.
- Ruggiero F. M., Cafagna F., Petruzzella V., Gadaleta M. N., Quagliariello E. Lipid composition in synaptic and nonsynaptic mitochondria from rat brains and effect of aging (англ.) // J Neurochem : journal. — 1991. — Vol. 59, no. 2. — P. 487—491. — doi:10.1111/j.1471-4159.1992.tb09396.x. — PMID 1629722.
- Ellis C. E., Murphy E. J., Mitchell D. C., Golovko M. Y., Scaglia F., Barcelo-Coblijn G. C., Nussbaum RL. Mitochondrial Lipid Abnormality and Electron Transport Chain Impairment in Mice Lacking α-Synuclein (англ.) // Mol Cell Biol : journal. — 2005. — Vol. 25, no. 22. — P. 10190—10201. — doi:10.1128/MCB.25.22.10190-10201.2005. — PMID 16260631.
- Dawson T. M., Dawson VL. Molecular pathways of neurodegeneration in Parkinson's disease (англ.) // Science : journal. — 2003. — Vol. 302, no. 5646. — P. 819—822. — doi:10.1126/science.1087753. — PMID 14593166.
- Gary J. Nabel. Immunology: Close to the Edge: Neutralizing the HIV-1 Envelope (англ.) // Science : journal. — 2005. — Vol. 308, no. 5730. — P. 1878—1879. — doi:10.1126/science.1114854. — PMID 15976295.
- Silvia Sánchez-Martínez et al. Membrane Association and Epitope Recognition by HIV-1 Neutralizing Anti-gp41 2F5 and 4E10 Antibodies (англ.) // AIDS Research and Human Retroviruses : journal. — 2006. — Vol. 22, no. 10. — P. 998—1006. — doi:10.1089/aid.2006.22.998. — PMID 17067270.
- BF Haynes et al. Cardiolipin Polyspecific Autoreactivity in Two Broadly Neutralizing HIV-1 Antibodies (англ.) // Science : journal. — 2005. — Vol. 308, no. 5730. — P. 1906—1908. — doi:10.1126/science.1111781. — PMID 15860590.
- J. M. Binley et al. Comprehensive Cross-Clade Neutralization Analysis of a Panel of Anti-Human Immunodeficiency Virus Type 1 Monoclonal Antibodies (англ.) // J. Virol. : journal. — 2004. — Vol. 78, no. 23. — P. 13232—13252. — doi:10.1128/JVI.78.23.13232-13252.2004. — PMID 15542675.
- Krebs, Hauser and Carafoli, Asymmetric Distribution of Phospholipids in the Inner Membrane of Beef Heart Mitochondria, Journal of Biological Chemistry, Vol. 254, No. 12, June 25, pp. 5308-5316, 1979.
- Michael A. Kiebish, et al. Cardiolipin and electron transport chain abnormalities in mouse brain tumor mitochondria: lipidomic evidence supporting the Warburg theory of cancer (англ.) // Journal of Lipid Research : journal. — 2008. — Vol. 49, no. 12. — P. 2545—2556. — doi:10.1194/jlr.M800319-JLR200. — PMID 18703489.
- Kulik W., van Lenthe H., Stet F. S., et al. Bloodspot assay using HPLC-tandem mass spectrometry for detection of Barth syndrome (англ.) // Clinical Chemistry : journal. — 2008. — February (vol. 54, no. 2). — P. 371—378. — doi:10.1373/clinchem.2007.095711. — PMID 18070816.
- Xu Y., Malhotra A., Ren M. and Schlame M. The enzymatic function of tafazzin (англ.) // J. Biol. Chem. : journal. — 2006. — Vol. 281, no. 51. — P. 39217—39224. — doi:10.1074/jbc.M606100200. — PMID 17082194.
- Bione S., D'Adamo P., Maestrini E., Gedeon A. K., Bolhuis P. A., Toniolo D. A novel X-linked gene, G4.5. is responsible for Barth syndrome (англ.) // Nature Genetics : journal. — 1996. — April (vol. 12, no. 4). — P. 385—389. — doi:10.1038/ng0496-385. — PMID 8630491.
