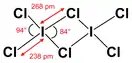
Гексахлорид дииода
Гексахлорид дииода — бинарное неорганическое соединение иода и хлора с формулой I2Cl6, оранжево-жёлтые кристаллы, реагирует с водой.
| Гексахлорид дииода | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
Гексахлорид дииода | ||
| Традиционные названия | Хлористый иод | ||
| Хим. формула | I2Cl6 | ||
| Физические свойства | |||
| Состояние | оранжево-жёлтые кристаллы | ||
| Молярная масса | 466,53 г/моль | ||
| Плотность | 3,203 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | под давл. 101 °C | ||
| • кипения | разл. 64 °C | ||
| Классификация | |||
| Рег. номер CAS | 865-44-1 | ||
| PubChem | 70076 | ||
| Рег. номер EINECS | 212-739-8 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 63265 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
- Растворение иода в избытке жидкого хлора:
- В расплаве монохлорида иода происходит обратимая реакция:
Физические свойства
Гексахлорид дииода образует оранжево-жёлтые кристаллы.
Расплав является электролитом, содержит ионы ICl2+ и ICl4—.
Химические свойства
- Разлагается при незначительном нагревании:
- Реагирует с холодной водой:
- и с горячей:
- С концентрированной соляной кислотой или хлоридами щелочных металлов образует комплексы:
- Реагирует с щелочами:
- Является сильным окислителем:
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.