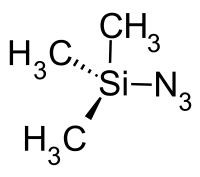
Триметилсилилазид
Триметилсилилазид — химическое соединение, алкил- и азидпроизводное моносилана с формулой (CH3)3SiN3, бесцветная жидкость.
| Триметилсилилазид[1][2] | |
|---|---|
 | |
| Общие | |
| Сокращения | TMSA |
| Хим. формула | (CH3)3SiN3 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 115,21 г/моль |
| Плотность | 0,868 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | −95 °C[3] |
| • кипения | 95-96 °C |
| • разложения | 500 °C |
| • вспышки | 23 °C |
| Оптические свойства | |
| Показатель преломления | 1,416 |
| Классификация | |
| Рег. номер CAS | 4648-54-8 |
| PubChem | 78378 |
| Рег. номер EINECS | 225-078-5 |
| SMILES | |
| InChI | |
| ChemSpider | 70747 |
| Безопасность | |
| Фразы риска (R) | R11, R23/24/25, R29, R50/53 |
| Фразы безопасности (S) | S16, S29, S36/37, S45, S57, S8 |
| Краткие характер. опасности (H) |
H225, H301+H311+H331 |
| Меры предостор. (P) |
P210, P280, P302+P352+P312, P304+P340+P312, P370+P378, P403+P235 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Триметилсилилазид получают кипячением триметилхлорсилана и азида натрия в дибутиловом эфире в течение 2 дней, после чего продукт перегоняют прямо из реакционного сосуда. Повторная перегонка позволяет получить триметилсилилазид с чистотой 99 %. Предложены также другие методики, где указанные компоненты вводятся в реакцию либо без растворителя, либо в более высококипящем растворителе (силиконовом масле или полиэтиленгликоле)[1].
Физические свойства
Растворяется в инертных органических растворителях.
Химические свойства и применение
Реакции замещения
Под действием триметилсилилазида в органических растворителях бензил-, аллил- и незамещённые алкилгалогениды превращаются в соответствующие органические азиды. При добавлении хлорида олова(IV) в качестве катализатора в азиды превращаются также вторичные, третичные, циклические и полициклические галогениды. Позже спектр используемых галогенидов (а также фосфатов и тозилатов) был расширен благодаря использованию в качестве активатора фторида тетрабутиламмония[1].
Ацилгалогениды в реакциях с триметилсилилазидом превращаются в соответствующие ацилазиды, которые сразу вступают в перегруппировку Курциуса, давая изоцианаты. Однако в присутствии иодида цинка хлорангидриды ароматических кислот с высоким выходом дают ацилазиды[1].
Ортоэфиры и ацетали реагируют с триметилсилилазидом в присутствии хлорида олова(IV) при −78 °С, давая соответствующие азиды[1].
Реакции присоединения
В присутствии хлорида цинка или хлорида олова(II) триметилсилилазид присоединяется к карбонильным соединениям, образуя α-триметилсилилоксиазиды. Альдегиды в эту реакцию вступают более активно, чем кетоны. Далее реакция в зависимости от условий приводит к диазидам, тетразолам или нитрилам[1].
Также триметилсилилазид присоединяется к оксиранам, давая β-триметилсилилоксиазиды, которые являются предшественниками β-аминоспиртов. Реакция катализируется хлоридом цинка, комплексами ванадия и титана, тартратом цинка и изопропоксидом алюминия. От катализатора зависит селективность процесса. Подобный процесс описан также для раскрытия азиридинов, которое позволяет получать 1,2-диамины[1].
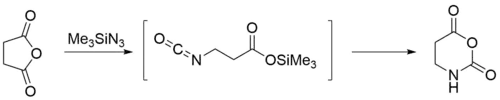
При присоединении триметилсилилазида к ангидридам карбоновых кислот образуется равное количество силилового эфира и изоцианата. Циклические ангидриды также присоединяют триметилсилилазид, однако в их случае образуются ω-триметилсилилоксикарбонилизоцианаты, которые далее циклизуются 1,3-оксазин-2,6-дионы.
Реакции циклоприсоединения
Триметилсилилазид присоединяется к алкинам по реакции [3+2]-диполярного циклоприсоединения, давая триазолы, а также к нитрилам — с образованием тетразолов[1].
Безопасность
Триметилсилилазид разлагается при 500 °С и является термически более стабильным, чем органические азиды. В холодильнике он хранится больше года. При контакте с водой он выделяет токсичную азотистоводородную кислоту, которая потенциально может вызывать вазодилатацию[1].
Примечания
- EROS, 2016.
- Azidotrimethylsilane. Sigma-Aldrich. Дата обращения: 29 декабря 2019.
- Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
Литература
- Nishiyama K., Wang C., Lebel H. Azidotrimethylsilane (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2016. — doi:10.1002/047084289X.ra117.pub3.
Ссылки
- ИК-спектр триметилсилилазида. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- КР-спектр триметилсилилазида. Sigma-Aldrich. Дата обращения: 29 июля 2019.