Сунитиниб
Сунитини́б — противоопухолевое средство, низкомолекулярный ингибитор различных (более 80) тирозинкиназ, участвующих в процессах роста опухолей, патологического ангиогенеза и образования метастазов[1][2].
| Сунитиниб | |
|---|---|
| Sunitinib | |
 | |
| Химическое соединение | |
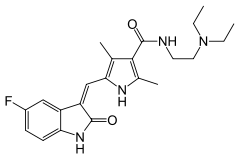
| ИЮПАК | N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3H-индол-3-илиден)метил]-2,4-диметил-1H-пиррол-3-карбоксамид |
| Брутто-формула | C22H27FN4O2 |
| Молярная масса |
398,474 г/моль; 532,561 г/моль (малат) |
| CAS | 341031-54-7 |
| PubChem | 5329102 |
| DrugBank | DB01268 |
| Состав | |
| Классификация | |
| Фармакол. группа |
Противоопухолевые средства — ингибиторы протеинкиназ |
| АТХ | L01XE04 |
| Фармакокинетика | |
| Биодоступн. | не зависит от пищи |
| Связывание с белками плазмы | 95 % |
| Метаболизм | печень |
| Период полувывед. |
40—60 часов (сунитиниб); 80—110 часов (метаболит) |
| Лекарственные формы | |
| желатиновые капсулы по 12,5, 25 и 50 мг | |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Сутент (Sutent®) | |
Применяется для лечения почечно-клеточного рака, резистентных гастроинтестинальных стромальных опухолей и тяжёлых случаев рака поджелудочной железы.
В качестве средства, применяемого при терапии почечно-клеточного рака и гастроинтестинальных стромальных опухолей, сунитиниб был зарегистрирован в США в январе 2006 года (одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, FDA)[3]. В России зарегистрирован для лечения больных раком почки в августе 2007 года[4], а в 2012 году включён в Перечень ЖНВЛП[5].
Препарат Сутент
Сунитиниб составляет основу противоопухолевого препарата, выпускаемого под торговым названием Сутент (Sutent) фармацевтической компанией Pfizer, Inc. (США) и предназначенного для перорального приёма. Лекарственная форма — желатиновые капсулы; в роли действующего вещества выступает малат сунитиниба[6].
Механизм действия
Основной мишенью сунитиниба являются α- и β-рецепторы тромбоцитарного фактора роста (PDGFR)[4]. Кроме того, он угнетает:
- рецепторы фактора роста эндотелия сосудов (VEGFR-1, VEGFR-2 и VEGFR-3);
- рецепторы фактора стволовых клеток (KIT);
- рецепторы Fms-подобной тирозинкиназы-3 (FLT-3);
- рецепторы колониестимулирующего фактора (CSF-1R);
- рецепторы нейротрофического глиального фактора (RET).
Фармакокинетика
Сунитиниб применяется перорально в форме малата, в желатиновых капсулах, независимо от приёма пищи[7]. После приёма препарата максимальная концентрация сунитиниба в плазме крови достигается примерно через 6—12 часов после приёма; приём пищи на биодоступность сунитиниба не влияет. Равновесные концентрации сунитиниба и его основного метаболита в плазме крови достигаются через 10—14 дней после начала приёма препарата. Связь сунитиниба и его метаболита с белками плазмы — 95 и 90 % соответственно[8].
Метаболизм сунитиниба происходит в основном в печени — за счёт окисления, опосредуемого изоферментом CYP3A4, в результате чего происходит образование основного активного метаболита (который дальше метаболизируется тем же изоферментом CYP3A4). Активность основного метаболита сходна с активностью самого сунитиниба. Доля циркулирующего в плазме активного метаболита составляет 23—37 % от величины площади под кривой «концентрация-время»[9].
Сунитиниб имеет период полувыведения 40—60 часов, его основной активный метаболит — 80—110 часов; выводится из организма преимущественно вместе с калом (60 %)[9][7].
Показания
Сунитиниб показан при[10]:
- распространённом и (или) метастатическом почечно-клеточном раке (в том числе, при отсутствии эффекта от терапии цитокинами);
- гастроинтестинальных стромальных опухолях при отсутствии эффекта от терапии иматинибом;
- нерезектабельных или метастатических нейроэндокринных опухолях поджелудочной железы[11].
Побочные эффекты
Ниже приводится перечень (неполный) основных нежелательных явлений, выявленных при применении сунитиба[12]. В зависимости от их характера и степени выраженности лечащий врач принимает решение: о продолжении лечения данным препаратом с использованием стандартной либо сниженной дозировки (и применением — при необходимости — местной симптоматической терапии); о приостановке приёма препарата на 7 или более дней; о прекращении терапии сунитинибом.
| Перечень побочных эффектов |
|---|
| В перечне упоминание каждого из данных нежелательных побочных эффектов сопровождается: пометкой «очень часто» — если частота возникновения эффекта больше 10 %; пометкой «часто» — если она лежит в пределах от 1 до 10 %; пометкой «нечасто» — если она лежит в пределах от 0,1 до 1 %. |
|
Противопоказания
Основным противопоказанием является повышенная чувствительность к сунитинибу. Препарат не должны применять беременные женщины, поскольку для плода препарат потенциально опасен, обладая тератогенным действием и эмбриотоксичностью (в экспериментах на животных выявлена способность сунитиниба вызывать пороки развития). Не установлены эффективность и безопасность применения препарата для детей и кормящих матерей. Следует проявлять осторожность пациентам с артериальной гипертензией, кожными заболеваниями, наличием кровотечений в анамнезе, заболеваниями сердца, при почечной или печёночной недостаточности[9].
Лекарственное взаимодействие
Рекомендуется избегать одновременного приёма препарата с потенциальными ингибиторами изофермента CYP3A4 (кетоконазол, ритонавир, итраконазол, эритромицин, кларитромицин, грейпфрутовый сок), способными повышать концентрацию сунитиниба в плазме крови; если этого сделать нельзя, может потребоваться уменьшение суточной дозы. Рекомендуется также избегать одновременного приёма с потенциальными индукторами изофермента CYP3A4 (рифампицин, дексаметазон, фенитоин, карбамазепин, фенобарбитал, зверобой продырявленный), способными понижать концентрацию сунитиниба в плазме крови; если этого сделать нельзя, может потребоваться поэтапное увеличение суточной дозы с тщательным мониторингом его переносимости[13].
Сунитиниб в таргетной терапии рака почки
Сунитиниб проявил себя — наряду с сорафенибом — как одно из наиболее многообещающих средств таргетной терапии почечно-клеточного рака. Эффективность данного средства изучалась, в частности, в двух исследованиях II фазы соответственно у 63 и 105 пациентов с метастатическим раком почки, которые не получили до этого положительного эффекта от терапии цитокинами. Частота частичных регрессий в данных исследованиях составила 40—43 %, стабилизации более чем на 3 месяца — 22—27 %. В исследованиях III фазы было показано, что применение сунитиниба приводило к более длительной безрецидивной выживаемости больных, чем терапия интерфероном-альфа[14].
Токсичность сунитиниба расценивается как умеренно выраженная; в то же время вопрос о профилактике и эффективной терапии токсических проявлений при терапии данным средством стоит весьма остро, поскольку (в отличие от рутинной терапии цитостатическими препаратами, которая осуществляется в ограниченные отрезки времени) лечение сунитинибом (и другими ингибиторами тирозинкиназ) носит непрерывный и длительный характер и продолжается иногда несколько лет. В этих условиях для врача весьма важны знание побочных эффектов применения сунитиниба, способов их профилактики и лечения, возможностей изменения дозы и режима назначения препарата, что позволяет минимизировать потребность в вынужденных перерывах таргетной терапии (чреватых бурным прогрессированием заболевания)[15].
Примечания
- «Клифар», Фармакологическое действие.
- Онкоурология. Фармакотерапия без ошибок, 2014, с. 116.
- FDA approves new treatment for gastrointestinal and kidney cancer. US Food and Drug Administration (2006). Дата обращения: 18 июня 2013. Архивировано 2 сентября 2013 года.
- Алексеев, Калпинский, 2008, с. 31.
- Распоряжение Правительства РФ от 7 декабря 2011 г. N 2199-р. Информационно-правовой портал Гарант.
- «Видаль», Описание препарата.
- По материалам фирмы-производителя: Patient Handbook
- Онкоурология. Фармакотерапия без ошибок, 2014, с. 132—133.
- Онкоурология. Фармакотерапия без ошибок, 2014, с. 133.
- «Клифар», Показания.
- «Видаль», Показания.
- «Видаль», Побочные эффекты.
- «Клифар», Взаимодействие.
- Алексеев, Шегай, 2007, с. 8.
- Алексеев, Калпинский, 2008, с. 31, 38.
Литература
- Алексеев Б. Я., Шегай П. В. Таргетная терапия распространённого рака почки // Онкоурология. — 2007. — № 4. — С. 6—11.
- Алексеев Б. Я., Калпинский А. С. Таргетная терапия распространенного рака почки Сутентом®: побочные эффекты и их коррекция // Онкоурология. — 2008. — № 3. — С. 31—38. Архивировано 20 июля 2012 года.
- Онкоурология. Фармакотерапия без ошибок / Под ред. И. Г. Русакова, В. И. Борисова. — М.: Е-ното, 2014. — 544 с. — ISBN 978-5-906023-07-0.
Ссылки
- Сунитиниб. Из базы данных по лекарственным средствам. «Клифар».
- Sutent Patient Handbook (англ.) (недоступная ссылка). Pfizer, Inc. (2012). Дата обращения: 18 июня 2013. Архивировано 20 июня 2012 года.
- Сутент. Описание препарата. Справочник «Видаль».