Респирасома
Современные биологические исследования выявили убедительные доказательства того, что митохондриальные ферменты дыхательной цепи переноса электронов собраны в более крупные, супрамолекулярные структуры, называемые респирасомы, что кардинально отличается от стандартной теории о свободно плавающих во внутренней мембране митохондрий дискретных ферментах. Эти суперкомплексы функционально активны и необходимы для стабильной работы дыхательных комплексов[1].
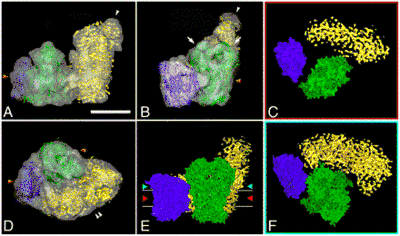
Респирасомы были обнаружены у разных видов и в разных тканях, включая мозг крыс[2], печень[2], почки[2], скелетные мышцы[2][3], сердце[2], бычье сердце[4], кожные фибробласты человека[5], грибы[6], растения[7][8] и С. elegans[9].
История
В 1955 году, биологи Бриттон Ченс и Г. Р. Вильямс впервые выдвинули идею, что дыхательные ферменты собираются в более крупные комплексы[10], хотя свободно-жидкостная модель организации дыхательной цепи всё ещё оставалась основной и считалась стандартной. Однако, уже в 1985 году, исследователи приступили к выделению суперкомплекса комплексов III/IV из бактерий[11][12][13] и дрожжей[14][15]. Наконец, в 2000 году Герман Шеггер и Кэти Пфайффер, используя гель-электрофорез с кумасси, изолировали индивидуальные бычьи дыхательные комплексы, показав, что комплекс I, III и IV образуют суперкомплекс[16].
Состав и образование
После того, как искомые респирасомы были выделены, всё ещё оставалась вероятность, что полученные комплексы образуются исключительно в пробирке и являются просто артефактом выделения. После нескольких лет безуспешных попыток доказать или опровергнуть существование респирасом с использованием различных методов выделения белков, Лапуента-Брун и соавт. решили использовать другой подход. Поскольку было очевидно, что если респирасомы действительно существует, то для объединения дыхательных комплексов в один суперкомплекс должен использоваться какой-нибудь вспомогательный белок. Выяснилось, что один белок под именем Cox7a2l (англ. cytochrome c oxidase subunit VIIa polypeptide 2-like) присутствует только в суперкомплексах, содержащих дыхательный комплекс IV (респирасомы и суперкомплексе III+IV) и никогда не встречается в одиночных комплексах. Исследователям посчастливилось случайно обнаружить, что в трёх мутантных линиях мышиных клеток с повреждённой формой этого белка в мембране митохондрий не удаётся выявить суперкомплексы с участием комплекса IV. При этом если в мутантные клетки вставить ген нормального белка, то в них начинают образовываться эти суперкомплексы. Из всего этого исследователи сделали закономерный вывод: данный белок помогает комплексу IV образовывать суперкомплексы и потому заслуживает того, чтобы быть переименованным в фактор объединения суперкомплексов I (англ. supercomplex assembly factor I, или SCAFI)[17].
Аналогичные белки, Rcf1 и Rcf2, стабилизирующие суперкомплексы были обнаружены у дрожжей[18].
К наиболее распространённым суперкомплексам относятся комплекс I/III, комплекс I/III/IV и комплекс III/IV. Большинство молекул комплекса II как в растительных так и в животных митохондриях находится в свободно виде. АТФ-синтаза тоже может мигрировать вместе с другими суперкомплексами в виде димера, но едва ли она входит в их состав[1].
Образование суперкомплекса является по-видимому динамическим процессом. Дыхательные комплексы могут чередовать участие в респирасомах и существование в свободном состоянии. Не известно, что запускает процесс организации дыхательных ферментов в суперкомплексы, но исследования показали, что их формирование во многом зависит от липидного состава митохондриальных мембран, и в частности требует наличия кардиолипина[19]. В дрожжевых митохондриях содержание кардиолипина понижено, а число обнаруженных респирасом было значительно ниже, чем у других организмов[19][20]. Согласно Венц и соавт. (2009), кардиолипин стабилизирует образование респирасом, нейтрализуя заряды остатков лизина в процессе взаимодействии домена комплекса III и комплекса IV[21]. В 2012 году, Базан и соавт. удалось in vitro получить тримерные и тетрамерные суперкомплексы состава III2IV1 и III2IV2 из очищенных комплексов III и IV Saccharomyces Сerevisiae, добавляя к ним липосомы с кардиолипином[22].
Другая гипотеза заключается в том, что риспирасомы могу образовываться под воздействием мембранного потенциала, который приводит к изменениям в электростатических и гидрофобных взаимодействиях, что и опосредует сборку или разборку суперкомплексов[23].
Согласно некоторым данным, респирасомы могут быть не самой высокой формой организации дыхательных комплексов. Основываясь на данных электронной микроскопии, а также на том факте, что комплексы IV из митохондрий быка способны при некоторых условиях образовывать тетрамеры, была выдвинута гипотеза о мегакомплексах, состоящих из респирасом или по иному дыхательных «цепей». Согласно этой модели, основу этой цепи составляет одиночный димер комплекса III (III2), окружённый с двух боков двумя комплексами IV. Эти структурные единицы соединяются через димеризацию, комплексов IV, в результате чего должна образовываться нить типа IV-IV-III2-IV-IV-III2, которая с боков плотно окружена комплексами I. Структурной единицей такой нити должен быть суперкомплекс состава I1III2IV[24].
Функции
Функциональное назначение респирасом не совсем понятно, но недавние исследования проливают свет на их предназначение. Была выдвинута гипотеза, что организация дыхательных ферментов в суперкомплексы сокращает окислительные повреждения и повышает эффективность обмена веществ. Шефер с соавт. (2006) продемонстрировали, что у суперкомплексов в составе которых есть комплекс IV, активность комплексов I и III была выше. Это указывает на то, что комплекс IV неким образом изменяет конформацию других комплексов что приводит к повышению их каталитической активности[25]. Постепенно стали накапливаться доказательства, что присутствие респирасом необходимо для стабильности и функционирования комплекса I, который в отсутствии комплексов III или IV практически нестабилен. Так, на мутантных клетках человека показано, что комплекс I является необходимым для формирования комплекса III, и с другой стороны, отсутствие комплекса III приводит к потере комплекса I. Кроме того, в ряде исследований на клетках животных приводятся доказательства того, что для стабильности комплекса I необходимы комплексы IV и димер комплекса III.
В 2013, Лапуента-Брун и соавт. продемонстрировали, что сборка суперкомплексов «динамически организует поток электронов, чтобы оптимизировать использование имеющихся субстратов». Наличие респирасом делает систему более разветвлённой и гибкой, что даёт возможность одновременно быстро окислять сразу несколько субстратов (сукцинат и пируват+малат), а вот если в митохондрии поступает исключительно сукцинат, который передаёт электроны в транспорт через ФАД, то в таком случае его окисление идёт быстрее в отсутствии респирасом[17].
Внешние ссылки
Примечания
- Vartak, Rasika; Porras, Christina Ann-Marie; Bai, Yidong. Respiratory supercomplexes: structure, function and assembly (англ.) // Protein & Cell : journal. — 2013. — Vol. 4, no. 8. — P. 582—590. — ISSN 1674-800X. — doi:10.1007/s13238-013-3032-y.
- Reifschneider, Nicole H.; Goto, Sataro; Nakamoto, Hideko; Takahashi, Ryoya; Sugawa, Michiru; Dencher, Norbert A.; Krause, Frank. Defining the Mitochondrial Proteomes from Five Rat Organs in a Physiologically Significant Context Using 2D Blue-Native/SDS-PAGE (англ.) // Journal of Proteome Research : journal. — 2006. — Vol. 5, no. 5. — P. 1117—1132. — ISSN 1535-3893. — doi:10.1021/pr0504440.
- Lombardi, A.; Silvestri, E.; Cioffi, F.; Senese, R.; Lanni, A.; Goglia, F.; de Lange, P.; Moreno, M. Defining the transcriptomic and proteomic profiles of rat ageing skeletal muscle by the use of a cDNA array, 2D- and Blue native-PAGE approach (англ.) // Journal of Proteomics : journal. — 2009. — Vol. 72, no. 4. — P. 708—721. — ISSN 18743919. — doi:10.1016/j.jprot.2009.02.007.
- Schäfer, Eva; Dencher, Norbert A.; Vonck, Janet; Parcej, David N. . Three-Dimensional Structure of the Respiratory Chain Supercomplex I1III2IV1from Bovine Heart Mitochondria†,‡ (англ.) // Biochemistry : journal. — 2007. — Vol. 46, no. 44. — P. 12579—12585. — ISSN 0006-2960. — doi:10.1021/bi700983h.
- Rodríguez-Hernández, Ángeles; Cordero, Mario D.; Salviati, Leonardo; Artuch, Rafael; Pineda, Mercé; Briones, Paz; Gómez Izquierdo, Lourdes; Cotán, David; Navas, Plácido; Sánchez-Alcázar, José A. Coenzyme Q deficiency triggers mitochondria degradation by mitophagy (англ.) // Autophagy : journal. — Taylor & Francis, 2009. — Vol. 5, no. 1. — P. 19—33. — ISSN 1554-8627. — doi:10.4161/auto.5.1.7174.
- Krause, F. OXPHOS Supercomplexes: Respiration and Life-Span Control in the Aging Model Podospora anserina (англ.) // Annals of the New York Academy of Sciences : journal. — 2006. — Vol. 1067, no. 1. — P. 106—115. — ISSN 0077-8923. — doi:10.1196/annals.1354.013.
- Eubel, Holger; Heinemeyer, Jesco; Sunderhaus, Stephanie; Braun, Hans-Peter. Respiratory chain supercomplexes in plant mitochondria (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2004. — Vol. 42, no. 12. — P. 937—942. — ISSN 09819428. — doi:10.1016/j.plaphy.2004.09.010.
- Sunderhaus, Stephanie; Klodmann, Jennifer; Lenz, Christof; Braun, Hans-Peter. Supramolecular structure of the OXPHOS system in highly thermogenic tissue of Arum maculatum (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2010. — Vol. 48, no. 4. — P. 265—272. — ISSN 09819428. — doi:10.1016/j.plaphy.2010.01.010.
- Suthammarak, Wichit; Somerlot, Benjamin H.; Opheim, Elyce; Sedensky, Margaret; Morgan, Philip G. Novel interactions between mitochondrial superoxide dismutases and the electron transport chain (англ.) // Aging Cell : journal. — 2013. — Vol. 12, no. 6. — P. 1132—1140. — ISSN 14749718. — doi:10.1111/acel.12144.
- Chance, Britton; Williams, G. R. A Method for the Localization of Sites for Oxidative Phosphorylation (англ.) // Nature : journal. — 1955. — Vol. 176, no. 4475. — P. 250—254. — ISSN 0028-0836. — doi:10.1038/176250a0.
- E. A. Berry & B. L. Trumpower. Isolation of ubiquinol oxidase from Paracoccus denitrificans and resolution into cytochrome bc1 and cytochrome c-aa3 complexes (англ.) // Journal of Biological Chemistry : journal. — 1985. — February (vol. 260, no. 4). — P. 2458—2467. — PMID 2982819.
- T. Iwasaki, K. Matsuura & T. Oshima. Resolution of the aerobic respiratory system of the thermoacidophilic archaeon, Sulfolobus sp. strain 7. I. The archaeal terminal oxidase supercomplex is a functional fusion of respiratory complexes III and IV with no c-type cytochromes (англ.) // Journal of Biological Chemistry : journal. — 1995. — December (vol. 270, no. 52). — P. 30881—30892. — doi:10.1074/jbc.270.52.30881. — PMID 8537342.
- N. Sone, M. Sekimachi & E. Kutoh. Identification and properties of a quinol oxidase super-complex composed of a bc1 complex and cytochrome oxidase in the thermophilic bacterium PS3 (англ.) // Journal of Biological Chemistry : journal. — 1987. — November (vol. 262, no. 32). — P. 15386—15391. — PMID 2824457.
- H. Boumans, L. A. Grivell & J. A. Berden. The respiratory chain in yeast behaves as a single functional unit (англ.) // Journal of Biological Chemistry : journal. — 1998. — February (vol. 273, no. 9). — P. 4872—4877. — doi:10.1074/jbc.273.9.4872. — PMID 9478928.
- C. Bruel, R. Brasseur & B. L. Trumpower. Subunit 8 of the Saccharomyces cerevisiae cytochrome bc1 complex interacts with succinate-ubiquinone reductase complex (англ.) // Journal of bioenergetics and biomembranes : journal. — 1996. — February (vol. 28, no. 1). — P. 59—68. — doi:10.1007/bf02109904. — PMID 8786239.
- H. Schagger & K. Pfeiffer. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria (англ.) // The EMBO journal : journal. — 2000. — April (vol. 19, no. 8). — P. 1777—1783. — doi:10.1093/emboj/19.8.1777. — PMID 10775262.
- Lapuente-Brun, E.; Moreno-Loshuertos, R.; Acin-Perez, R.; Latorre-Pellicer, A.; Colas, C.; Balsa, E.; Perales-Clemente, E.; Quiros, P. M.; Calvo, E.; Rodriguez-Hernandez, M. A.; Navas, P.; Cruz, R.; Carracedo, A.; Lopez-Otin, C.; Perez-Martos, A.; Fernandez-Silva, P.; Fernandez-Vizarra, E.; Enriquez, J. A. Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain (англ.) // Science : journal. — 2013. — Vol. 340, no. 6140. — P. 1567—1570. — ISSN 0036-8075. — doi:10.1126/science.1230381.
- Rcf1 and Rcf2, Members of the Hypoxia-Induced Gene 1 Protein Family, Are Critical Components of the Mitochondrial Cytochrome bc1-Cytochrome c Oxidase Supercomplex (англ.) // Mol Cell Biol : journal. — 2012. — Vol. 32, no. 8. — P. 1363—1373. — doi:10.1128/MCB.06369-11.
- Gluing the Respiratory Chain Together. CARDIOLIPIN IS REQUIRED FOR SUPERCOMPLEX FORMATION IN THE INNER MITOCHONDRIAL MEMBRANE (англ.) // Journal of Biological Chemistry : journal. — 2002. — Vol. 277, no. 46. — P. 43553—43556. — ISSN 00219258. — doi:10.1074/jbc.C200551200.
- Zhang M. Cardiolipin Is Essential for Organization of Complexes III and IV into a Supercomplex in Intact Yeast Mitochondria (англ.) // Journal of Biological Chemistry : journal. — 2005. — Vol. 280, no. 33. — P. 29403—29408. — ISSN 0021-9258. — doi:10.1074/jbc.M504955200.
- Wenz Tina, Hielscher Ruth, Hellwig Petra,Schägger Hermann, Richers Sebastian, Hunte Carola. Role of phospholipids in respiratory cytochrome bc1 complex catalysis and supercomplex formation (англ.) // Biochimica et Biophysica Acta (BBA) - Bioenergetics : journal. — 2009. — Vol. 1787, no. 6. — P. 609—616. — ISSN 00052728. — doi:10.1016/j.bbabio.2009.02.012.
- Bazan, S.; Mileykovskaya, E.; Mallampalli, V. K. P. S.; Heacock, P.; Sparagna, G. C.; Dowhan, W. Cardiolipin-dependent Reconstitution of Respiratory Supercomplexes from Purified Saccharomyces cerevisiae Complexes III and IV (англ.) // Journal of Biological Chemistry : journal. — 2012. — Vol. 288, no. 1. — P. 401—411. — ISSN 0021-9258. — doi:10.1074/jbc.M112.425876.
- Lenaz Giorgio, Genova Maria Luisa. Supramolecular Organisation of the Mitochondrial Respiratory Chain: A New Challenge for the Mechanism and Control of Oxidative Phosphorylation (англ.) : journal. — 2012. — Vol. 748. — P. 107—144. — ISSN 0065-2598. — doi:10.1007/978-1-4614-3573-0_5.
- Wittig Ilka, Schägger Hermann. Supramolecular organization of ATP synthase and respiratory chain in mitochondrial membranes // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — 2009. — Июнь (т. 1787, № 6). — С. 672—680. — ISSN 0005-2728. — doi:10.1016/j.bbabio.2008.12.016.
- Schafer E. Architecture of Active Mammalian Respiratory Chain Supercomplexes (англ.) // Journal of Biological Chemistry : journal. — 2006. — Vol. 281, no. 22. — P. 15370—15375. — ISSN 0021-9258. — doi:10.1074/jbc.M513525200.