Кумасси
Coomassie Brilliant Blue (кумасси бриллиантовый синий) — название двух близких трифенилметановых красителей, разработанных для текстильной индустрии, но в настоящее время широко используемых в аналитической биохимии для окраски белков. Coomassie Brilliant Blue G-250 отличается от R-250 наличием двух метильных групп. Название «Coomassie» — зарегистрированный товарный знак Imperial Chemical Industries.
| Coomassie Brilliant Blue | |
|---|---|
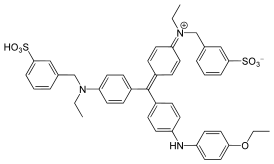 | |
| Общие | |
| Традиционные названия |
C.I. 42660, C.I. Acid Blue 83 Brilliant indocyanine 6B, Brillantindocyanin 6B Brilliant Cyanine 6B, Serva Blue R |
| Хим. формула | C45H44N3NaO7S2 (натриевая соль) |
| Физические свойства | |
| Молярная масса | 825,97 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворимо в холодной воде, плохо растворимо в горячей воде, растворимо в этаноле |
| Классификация | |
| Рег. номер CAS | 6104-59-2 |
| PubChem | 61365 |
| Рег. номер EINECS | 228-060-5 |
| SMILES |
[http://chemapps.stolaf.edu/jmol/jmol.php?model=CCN%28CC1%3DCC%28%3DCC%3DC1%29S%28%3DO%29%28%3DO%29%5BO-%5D%29C2%3DCC%3DC%28C%3DC2%29C%28%3DC3C%3DCC%28%3D%5BN%2B%5D%28CC%29CC4%3DCC%28%3D%0ACC%3DC4%29S%28%3DO%29%28%3DO%29%5BO-%5D%29C%3DC3%29C5%3DCC%3DC%28C%3DC5%29NC6%3DCC%3DC%28C%3DC6%29OCC.%5BNa%2B%5D CCN(CC1=CC(=CC=C1)S(=O)(=O)[O-])C2=CC=C(C=C2)C(=C3C=CC(=[N+](CC)CC4=CC(=
CC=C4)S(=O)(=O)[O-])C=C3)C5=CC=C(C=C5)NC6=CC=C(C=C6)OCC.[Na+]] |
| InChI | |
| ChemSpider | 55296 |
| Безопасность | |
| Краткие характер. опасности (H) |
H201, H202, H235+H410 |
| Меры предостор. (P) |
P201 |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Название и история открытия
Название Кумасси было зарегистрировано в конце 19 века в качестве торговой марки компанией Blackley, для красителей шерсти.[1] В 1896 году в ходе Четвертой Англо-ашантийской войны, войска Великобритании заняли город Coomassie (в настоящее время Кумаси в Гане). В 1918 году компания Levinstein Ltd, владелец торговой марки Кумасси, стала частью компании British Dyestuffs, которая в 1926 году была поглощена компанией Imperial Chemical Industries.[2] В настоящее время компания Imperial Chemical Industries не производит красителей, но остается владельцем торговой марки Coomassie .
Синие красители на основе сернистных производных трифенилметана были впервые получены в 1913 году Максом Вейлером, который работал в городе Вупперталь (Германия).[3][4][5][6]
Статьи в биохимических журналах часто не расшифровывают, какой именно краситель «Coomassie» был использован. Перечень цветов en:Colour Index International содержит более 40 красителей, содержащих термин «Coomassie» в названии. Синий краситель кумасси из перечня Merck Index (10th edition) — Coomassie Blue RL (Acid Blue 92, C.I. 13390) имеет совершенно иную структуру.
Цвет красителя

Суффикс «R» в названии красителя Coomassie Brilliant Blue R-250 является аббревиатурой от слова Red (красный), так как синий цвет красителя имеет слабый красноватый оттенок. Вариант красителя с суффиксом «G» имеет слабый зеленоватый оттенок. Цифры «250» обозначали чистоту красителя.
Цвет красителей зависит от кислотности среды. Краситель «G» подробно изучен.[7] При pH ниже 0 краситель имеет красную окраску и максимум поглощения на длине 470 нм. При pH около 1 краситель зеленый и максимум поглощения составляет 620 нм. При рН выше 2 краситель ярко-синий, максимум поглощения на 595. При pH 7 краситель имеет коэффициент молярной экстинкции 43,000 M−1см−1.[7]
Изменение окраски раствора соответствует изменению заряда молекулы красителя. В красной форме три атома азота заряжены положительно. Два остатка серной кислоты имеют очень низкий pKa и потому обычно заряжены отрицательно, поэтому при pH близких к нулю, краситель представляет собой катион с суммарным зарядом +1. Зеленый цвет соответствует незаряженной молекуле. При pH 7 лишь атом азота в составе дифениламина имеет положительный заряд, поэтому молекула в целом является анионом с суммарным зарядом −1. Значения pKa, необходимые для потери двух протонов составляют 1,15 и 1,82. Последний протон отрывается в щелочной среде, при этом молекула приобретает розовую окраску (pKa 12,4).[7]
Красители образуют комплекс с анионными детергентами, например, с лаурилсульфатом натрия.[8] Образование такого комплекса стабилизирует зеленый цвет нейтральной формы красителя. Этот эффект может оказывать влияние на определение концентрации при помощи метода Бредфорда. Вероятно, анионные детергенты конкурируют с красителем за связывание с белком.
Использование в биохимии

Coomassie Brilliant Blue R-250 был использован для окрашивания белков в 1964 году[9]. Образцы белков были разделены электрофорезом на листе ацетата целлюлозы. Лист помещали в сульфосалициловую кислоту для фиксации белков и затем переносили в раствор красителя.
В 1965 году Coomassie Brilliant Blue R-250 был использован для окрашивания белков после электрофоретического разделения в полиакриламидном геле[10]. Гель помещали в раствор красителя, содержащий метанол, уксусную кислоту и воду. После окрашивания белков полиакриамидный гель (ПААГ) должен был быть отмыт электрофоретически. Далее было показано, что гель может быть отмыт раствором уксусной кислоты.
Краситель «G» был впервые использован для визуализации белков в полиакриламидном геле в 1967 году, при этом краситель растворяли в растворе уксусной кислоты с метанолом[11].
Позднее было показано, что белковые полосы могут быть окрашены без коллоидного красителя «G», в растворе трихлоруксусной кислоты без метанола. Использование этого протокола не требует отмывания геля[12].
Современные протоколы используют коллоидную форму красителя «G» в растворе, содержащем фосфорную кислоту, этанол (или метанол) и сульфат аммония[13][14][15][16].
Метод Бредфорда использует спектральные свойства Coomassie Brilliant Blue G-250 для определения количества белка в растворе[17]. Для этого к образцу белка добавляют раствор красителя в фосфорной кислоте и этаноле. В кислых условиях краска имеет коричневый цвет, но при связывании с белком становится синей. Оптическое поглощение раствора измеряют на длине волны 595 нм.
Связывание белка с отрицательно заряженным Coomassie Brilliant Blue G-250 придаёт белку отрицательный заряд, что может быть использовано при разделении смесей белков в ПААГ в неденатурирующих условиях при помощи метода Blue Native PAGE[18][19].
Подвижность комплекса в полиакриламидном геле зависит от размера белка, белкового комплекса, а также количества красителя, связываемого белком.
См. также
Примечания
- Fox, M. R. Dye-makers of Great Britain 1856-1976 : A History of Chemists, Companies, Products and Changes (англ.). — Manchester: Imperial Chemical Industries, 1987. — P. 38.
- Fox, M. R. Dye-makers of Great Britain 1856-1976 : A History of Chemists, Companies, Products and Changes (англ.). — Manchester: Imperial Chemical Industries, 1987. — P. 259.
- Colour Index (неопр.). — 3rd. — Bradford: Society of Dyers and Colourists, 1971. — Т. 4. — С. 4397—4398. Архивированная копия (недоступная ссылка). Дата обращения: 27 мая 2013. Архивировано 19 июля 2011 года.
- , "Procédé de production de colorants de la série du triarylméthane", FR patent 474260, issued 1915-02-16
- Weiler, Max, "Blue Triphenylmethane Dye", US patent 1218232, issued 1917-03-06
- , "Manufacture of Triarylmethane-dyestuffs", GB patent 275609, issued 1927-11-03
- Chial, H. J.; Thompson, H. B.; Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G (англ.) // Analytical Biochemistry : journal. — 1993. — Vol. 209, no. 2. — P. 258—266. — doi:10.1006/abio.1993.1117. — PMID 7682385.
- Compton, S. J.; Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay (англ.) // Analytical Biochemistry : journal. — 1985. — Vol. 151, no. 2. — P. 369—374. — doi:10.1016/0003-2697(85)90190-3. — PMID 4096375.
- Fazekas de St. Groth, S.; Webster, R. G.; Datyner, A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips (англ.) // Biochimica et Biophysica Acta : journal. — 1963. — Vol. 71. — P. 377—391. — doi:10.1016/0006-3002(63)91092-8. — PMID 18421828.
- Meyer, T. S.; Lambert, B. L. Use of Coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips (англ.) // Biochimica et Biophysica Acta : journal. — 1965. — Vol. 107, no. 1. — P. 144—145. — doi:10.1016/0304-4165(65)90403-4. — PMID 4159310.
- Altschul, A. M.; Evans, W. J. Zone electrophoresis with polyacrylamide gel (англ.) // Methods in Enzymology : journal. — 1967. — Vol. 11. — P. 179—186. — doi:10.1016/S0076-6879(67)11019-7.. Page 184 personal communication from W. J. Saphonov.
- Diezel, W.; Kopperschläger, G.; Hofmann, E. An improved procedure for protein staining in polyacrylamide gels with a new type of Coomassie Brilliant Blue (англ.) // Analytical Biochemistry : journal. — 1972. — Vol. 48, no. 2. — P. 617—620. — doi:10.1016/0003-2697(72)90117-0. — PMID 4115985.
- Neuhoff, V.; Stamm, R.; Eibl, H. Clear background and highly sensitive protein staining with Coomassie Blue dyes in polyacrylamide gels: a systematic analysis (англ.) // Electrophoresis : journal. — 1985. — Vol. 6, no. 9. — P. 427—448. — doi:10.1002/elps.1150060905.
- Candiano, G.; Bruschi, M.; Musante, L.; Santucci, L.; Ghiggeri, G. M.; Carnemolla, B.; Orecchia, P.; Zardi, L.; Righetti, P. G. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis (англ.) // Electrophoresis : journal. — 2004. — Vol. 25, no. 9. — P. 1327—1333. — doi:10.1002/elps.200305844. — PMID 15174055.
- Steinberg, T. H. Protein gel staining methods: an introduction and overview (англ.) // Methods in Enzymology : journal. — 2009. — Vol. 463. — P. 541—563. — doi:10.1016/S0076-6879(09)63031-7. — PMID 19892191.
- Pink, M.; Verma, N.; Rettenmeier, A. W.; Schmitz-Spanke, S. CBB staining protocol with higher sensitivity and mass spectrometric compatibility (англ.) // Electrophoresis : journal. — 2010. — Vol. 31, no. 4. — P. 593—598. — doi:10.1002/elps.200900481. — PMID 20162584.
- Bradford, M. M. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding (англ.) // Analytical Biochemistry : journal. — 1976. — Vol. 72. — P. 248—254. — doi:10.1016/0003-2697(76)90527-3. — PMID 942051.
- Schägger, H.; Jagow, G. Blue native electrophoresis for isolation of membrane protein complexes in enzymatically active form (англ.) // Analytical Biochemistry : journal. — 1991. — Vol. 199, no. 2. — P. 223—231. — doi:10.1016/0003-2697(91)90094-A. — PMID 1812789.
- Wittig, I.; Braun, H. P.; Schägger, H. Blue native PAGE (англ.) // Nature Protocols : journal. — 2006. — Vol. 1, no. 1. — P. 418—428. — doi:10.1038/nprot.2006.62. — PMID 17406264.
Литература
- Gessner, T. & Mayer, U. (2002), Triarylmethane and Diarylmethane Dyes, Ullmann's Encyclopedia of Industrial Chemistry 6th Edition, Weinheim: Wiley-VCH, DOI 10.1002/14356007.a27_179
