Оксид-трихлорид ванадия
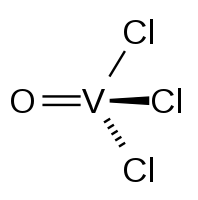
Оксид-трихлорид ванадия (оксотрихлорид ванадия) — неорганическое соединение, оксосоль металла ванадия и соляной кислоты с формулой VOCl3, оранжево-жёлтая прозрачная жидкость, с резким запахом, дымящая на воздухе и гидролизующаяся водой.
| Оксид-трихлорид ванадия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Оксид-трихлорид ванадия |
| Традиционные названия | хлорокись ванадия; оксотрихлорид ванадия |
| Хим. формула | VOCl3 |
| Физические свойства | |
| Состояние | жёлтая жидкость |
| Молярная масса | 173,30 г/моль |
| Плотность | 1,76; 1,839 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -79,5; -77 °C |
| • кипения | 126,7; 127 °C |
| Энтальпия | |
| • образования | -740,7 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7727-18-6 |
| PubChem | 24410 |
| Рег. номер EINECS | 231-780-2 |
| SMILES | |
| InChI | |
| RTECS | YW2975000 |
| Номер ООН | 2443 |
| ChemSpider | 10613097 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Взаимодействие оксида ванадия(V) с тионилхлоридом при кипячении смеси:
- Хлорирование смеси оксида ванадия(V) и угля:
- Вместо хлорирования в присутствии углерода можно пропускать над оксидом ванадия(V) тетрахлорид углерода:
- Хлорирование оксида ванадия(III) :
- Окисление кислородом при нагревании хлорида ванадия(III):
- Также VOCl3 образуется при разложении хлорида диоксованадия(V), но этот способ имеет лишь теоретический интерес:
Физические свойства
Оксид-трихлорид ванадия — оранжево-жёлтая прозрачная жидкость, дымит во влажном воздухе вследствие гидролиза с образованием хлороводорода. Растворение в воде сопровождается химическим взаимодействием. Растворяется в этаноле, диэтиловом эфире , уксусной кислоте, тетрахлориде углерода.
Химические свойства
- Реагирует с водой:
- В зависимости от концентрации раствора образуются гели различного состава, которые постепенно окисляют хлорид-ионы, переходя при этом в производные ванадила.
- В концентрированной азотной кислоте реакция с водой идёт иначе:
- Реагирует с растворами щелочей, при недостатке щелочи выпадает гель оксида ванадия(V):
- При избытке щелочи образуются различные ванадаты(V) в зависимости от концентрации щёлочи:
- С концентрированным раствором аммиака образуется метаванадат аммония:
- Восстанавливается водородом:
- Восстанавливается цинком:
- При взаимодействии с оксидом хлора(I) или озоном образуется хлорид диоксованадия(V):
- Взаимодействием оксохлорида ванадия(V) со спиртами были получены алкоксиды состава VO(OR)3, представляющие собой летучие жидкости или легко возгоняющиеся кристаллы, состоящие из димерных молекул. Избытком воды они гидролизуются с образованием красного геля состава V2O5∙18H2O:
Применение
- Катализатор в органическом синтезе.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия. В 3 т. / Под ред. Ю. Д. Третьякова. — М.: Изд. центр «Академия», 2007. — Т. 3 кн. 1. — 352 с. — ISBN 5-7695-2532-0.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
