Негомологичное соединение концов
Негомологи́чное соедине́ние концо́в[1], или негомологи́чное воссоедине́ние концо́в[2] (англ. non-homologous end joining, NHEJ) — один из путей репарации двунитевых разрывов в ДНК. Негомологичным этот процесс называется потому, что повреждённые концы цепи соединяются лигазой напрямую, не нуждаясь в гомологичном шаблоне, в отличие от процесса гомологичной рекомбинации[3][4][5][6]. NHEJ существенно менее точен, чем гомологичная рекомбинация, и часто он приводит к потере нуклеотидов, транслокациям или слиянию теломер, при этом последние два могут являться признаками опухолевой клетки[7]. NHEJ обнаружен у представителей всех царств живой природы, кроме того, в клетках млекопитающих он служит основным путём репарации двуцепочечных разрывов[8].
У прокариот
Многие виды бактерий, включая Escherichia coli, не имеют NHEJ, а потому вынуждены полагаться только на гомологичную рекомбинацию в случае повреждения ДНК бактерии. Однако белки, участвующие в NHEJ, были обнаружены у некоторых бактерий, например, у Bacillus subtilis, Mycobacterium tuberculosis и Mycobacterium smegmatis[9][10]. Бактерии используют исключительно компактную версию NHEJ, где все необходимые действия выполняются всего двумя белками: гетеродимером белка Ku и многофункциональной лигазой/полимеразой/нуклеазой LigD[11]. У микобактерий NHEJ гораздо больше подвержен ошибкам, чем у дрожжей[10]. Многие бактерии, обладающие белками NHEJ, проводят значительную часть своего жизненного цикла в стационарном гаплоидном состоянии, когда шаблон для рекомбинации недоступен и гомологичная рекомбинация невозможна[9]. Возможно, у этих бактерий NHEJ помогает восстанавливать двуцепочечные разрывы, возникающие при высыхании[12]. Corndog и Omega, два родственных бактериофага из Mycobacterium smegmatis, также используют NHEJ, чтобы разомкнуть свой геном во время инфекции[13].
NHEJ является одним из путей восстановления двуцепочечных разрывов и у архей. У архей NHEJ также включает связывание и удержание концов разрыва белками Ku с последующим застраиванием бреши. У архей Ku связывают концы, которые были «подрезаны» экзонуклеазой так, что образуется выступающий 3'-конец, который может быть продлен за счёт синтеза цепи ДНК с вытеснением старой цепи ДНК-полимеразой[14].
У эукариот
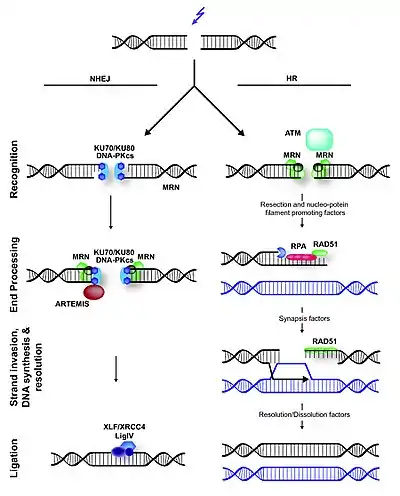
В отличие от бактерий, эукариотический NHEJ использует обширный ряд белков, участвующих в осуществлении следующих шагов[15]:
- Распознавание двунитевого разрыва ДНК гетеродимерным белком Ku70/Ku80;
- Сборка и стабилизация комплекса NHEJ-белков на месте повреждения ДНК;
- Смыкание концов разрыва и их стабилизация;
- Активация киназной активности ДНК-зависимой протеинкиназы (ДНК-зависимые протеинкиназы);
- Процессинг концов разрыва, если требуется;
- Лигирование концов разрыва;
- Распад комплекса NHEJ-белков на месте отрепарированного разрыва.
Когда механизм NHEJ неактивен, двунитевые разрывы могут быть устранены альтернативным путём, более подверженным ошибкам, — путём микрогомологичного соединения концов (англ. microhomology-mediated end joining (MMEJ)). При этом пути по обе стороны от разрыва сначала образуются короткие гомологичные последовательности (микрогомологи), которые затем подравниваются в ходе репарации[16].
Связывание и фиксирование концов
У дрожжей комплекс MRX, состоящий из белков Mre11, Rad50 и Xrs2, привлекается в процесс репарации рано и, как предполагается, помогает сцеплять ДНК-концы[17]. Соответствующий комплекс у млекопитающих, известный как комплекс (MRN), состоит из белков Mre11, Rad50 и Nbs1 и также вовлекается в NHEJ, но он может действовать и на других этапах процесса, помимо удержания концов разрыва в непосредственной близости друг от друга[18].
Эукариотический белок Ku представляет собой гетеродимер, состоящий из Ku70 и Ku80, формирующий комплекс с ДНК-зависимой протеинкиназой, которая есть у млекопитающих, но отсутствует у дрожжей. Белок Ku имеет форму корзинки и «скользит» вдоль ДНК-цепи. По сути, он выступает сенсором, обнаруживающим повреждения ДНК[1]. Он может функционировать и в качестве сайта докинга для других молекул, вовлеченных в NHEJ, а также взаимодействует с комплексом ДНК-лигазы IV и белком XLF[19][20].
ДНК-зависимая протеинкиназа DNA-PK
У эукариот центральную роль в NHEJ-репарации и ответе на повреждение ДНК играет ДНК-зависимая протеинкиназа DNA-PK, состоящая из каталитической субъединицы DNA-PKcs, соединённой с С-концом белка Ku80. DNA-PKcs рекрутируется к С-концу белка Ku80 после образования комплекса Ku70/Ku80 на концах двунитевого разрыва ДНК. После этого DNA-PKcs аутофосфорилируется и фосфорилирует ряд белков, участвующих в ответе на повреждение ДНК, включая белок Artemis[21]. Предполагается, что ДНК-зависимые протеинкиназы тоже участвуют в соединении концов во время NHEJ[22].
Обработка концов разрыва
Обработка концов включает в себя удаление нескольких нуклеотидов из выступающих концов с помощью нуклеазы и восстановления двуцепочечной структуры посредством ДНК-полимеразы. Этот шаг не является необходимым, если концы уже совместимы, то есть имеют свободные 3'-гидроксильную и 5'-фосфатную группу. Например, белок Artemis, активируемый ДНК-зависимой протеинкиназой, может функционировать и как эндонуклеаза, и как экзонуклеаза в ходе V(D)J-рекомбинации. Mre11 обладает активностью нуклеазы, но, по-видимому, вовлечён в процесс гомологичной рекомбинации, а не NHEJ. Далее ДНК-полимеразы λ и μ (Pol4 у дрожжей) восстанавливают двуцепочечную структуру ДНК на месте выступающих одноцепочечных концов. Таким образом, концы разрыва делаются тупыми[5][23][24][1].
Лигирование
Комплекс ДНК-лигазы IV, состоящий из каталитической субъединицы ДНК-лигазы IV и кофактора XRCC4 (Dnl4 и Lif1 у дрожей), осуществляет лигирование на завершающем этапе NHEJ[25]. В нём также принимает участие белок XLF (у дрожжей Nej1)[26][27]. Точная роль XLF неизвестна, однако известно, что он взаимодействует с комплексом XRCC4/ДНК-лигазы IV и, вероятно, участвует в процессе лигирования[28]. Последние данные свидетельствуют о том, что XLF способствует реаденилированию ДНК-лигазы IV после лигирования, «перезаряжая» её, благодаря чему она может катализировать второе лигирование[29].
Регуляция
Выбор между гомологичной и негомологичной репарациями повреждений ДНК регулируется на начальном этапе рекомбинации — подравнивании одноцепочечных выступающих участков. Концы, которые не подвергавшиеся подравниванию, могут быть соединены посредством NHEJ, а удаление на этапе подравнивания даже нескольких нуклеотидов подавляет NHEJ, и репарация производится посредством гомологичной рекомбинации[24]. NHEJ может происходить на протяжении всего клеточного цикла, но он наиболее активен в G1-фазе, когда нет доступных шаблонов для гомологичной рекомбинации. Важную роль в регуляции NHEJ играет циклинзависимая киназа 1 (Cdk1; cdc28 у дрожжей), которая отключается в G1-фазе и экспрессируется в S и G2 фазах. Cdk1 фосфорилирует нуклеазу Sae2, что запускает подравнивание концов[30].
Запуск пути NHEJ начинается с привлечения к области повреждения белка 53BP1, который способствует дальнейшей репарации двуцепочечного разрыва по пути NHEJ. До момента подрезания концов возможно переключение на гомологичную рекомбинацию, которое достигается путём привлечения к поврежденной области белка-антагониста 53BP1 — BRCA1. Если BRCA1 вытесняет 53BP1, то двуцепочечный разрыв будет восстановлен по пути гомологичной рекомбинации[31]. Помимо 53BP1 и BRCA1, в выборе пути для устранения двуцепочечного разрыва задействованы белки RIF1 и CtIP — нуклеаза, задействованная в подрезании концов на первых этапах гомологичной рекомбинации. Таким образом, 53BP1 и RIF1 направляют восстановление по пути негомологичного соединения концов, а BRCA1 и CtIP — по пути гомологичной рекомбинации[32].
Гомологичная рекомбинация для восстановления двуцепочечных разрывов может быть использована только в S- и G2-фазах, когда в результате удвоения ДНК появляется матрица для репарации (поэтому NHEJ, активный во время всего клеточного цикла, является основным механизмом восстановления двуцепочечных разрывов в клетках млекопитающих). Исключение составляют области генома, содержащие повторы, например, повторы генов, кодирующих рРНК (рДНК). В рДНК матрица для восстановления двуцепочечного разрыва в повторе имеется в течение всего клеточного цикла, ей может выступать любой другой повтор. В случае рДНК мелкие повреждения быстро устраняются NHEJ внутри ядрышка (время протекания NHEJ составляет около 30 минут, а гомологичной рекомбинации — примерно 7 часов), а крупные и сложные повреждения перемещаются вместе с белками фибриллярных центров и плотного фибриллярного компонента на периферию, образуя так называемый ядрышковый кэп. В ядрышковом кэпе происходят все, кроме самых первых, этапы гомологичной рекомбинации, при этом повторы рДНК сближаются, что способствует рекомбинации. В ядрышковых кэпах NHEJ не происходит[33]. На выбор пути восстановления двуцепочечного разрыва также влияет сложность повреждения. NHEJ, как правило, используется для устранения небольших повреждений[34].
V(D)J-рекомбинация
NHEJ играет важную роль в V(D)J рекомбинации — процессе, посредством которого создаётся разнообразие B-клеточных и T-клеточных рецепторов в иммунной системе позвоночных[35]. В начале процесса нуклеазы RAG1/RAG2 создают двуцепочечные разрывы, защищённые шпильками, в области особых сигнальных последовательностей[36] Далее нуклеаза Artemis срезает шпильки, и образовавшиеся концы соединяются посредством NHEJ[37]. Специализированная ДНК-полимераза, называемая трансферазой концевых дезоксинуклеотидов, работающая только в лимфоидных тканях, добавляет нешаблонные нуклеотиды к концами цепи до того, как последние будут соединены. Этот процесс перестраивает и объединяет участки V (variable), D (diversity) и J (joining), с которых потом считывается вариабельный участок Т-клеточных и В-клеточных рецепторов. В отличие от типичного NHEJ, в котором точная репарация — это самый благоприятный исход, для V(D)J-рекомбинации выгоднее, чтобы NHEJ работал с ошибками, поскольку это повышает разнообразие кодирующих последовательностей генов[38][39].
В теломерах
Теломеры обычно защищены специальным белковым «кэпом», благодаря чему они не распознаются как двухцепочечные разрывы. Потеря кэпа вызывает укорочение теломер и их соединение посредством NHEJ, что приводит к формированию дицентрической хромосомы, разрывающейся во время митоза. Любопытно, что некоторые белки NHEJ участвуют в формировании кэпа теломеры. Например, удаление Ku, находящегося на теломерах, приводит к их укорочению[40].
Клиническое значение
Несколько человеческих болезней связаны с дисфункцией NHEJ[41]. Мутации, затрагивающие LIG4 и XLF, являются причиной LIG4-синдрома и XLF-связанного тяжёлого комбинированного иммунодефицита (ТКИД), соответственно. Эти синдромы имеют много характерных черт, включая клеточную радиочувствительность, микроцефалию и ТКИД, обусловленный дефектами в V(D)J-рекомбинации. Мутации в Artemis также приводят к ТКИД, но при них не развиваются неврологические дефекты, как при мутациях в LIG4 и XLF. Разница в тяжести болезней может объясняться ролью мутировавших белков: Artemis — это нуклеаза, необходимая, вероятно, только для репарации двухцепочечных разрывов с повреждёнными концами, когда как ДНК-лигаза IV и XLF принимают участие во всех вариантах NHEJ. Мутации в белках NHEJ также могут приводить к атаксии телеангиэктазии, анемии Фанкони, а также наследственному раку груди и яичников. Мыши, нокаутные по XRCC4 или LIG4, умирали на стадии эмбрионального развития, поэтому NHEJ является жизненно необходимым процессом для млекопитающих. Напротив, мыши, лишённые Ku или ДНК-зависимой протеинкиназы, оказались жизнеспособны, вероятно, потому, что NHEJ всё-таки может происходить без этих белков, хотя и на низком уровне[42].
Влияние на старение
Была разработана система для измерения эффективности NHEJ в клетках мышей[43]. С её помощью можно сравнить эффективность NHEJ в разных тканях и у мышей разных возрастов. Наиболее активно NHEJ идёт в клетках кожи, лёгких и почечных фибробластах, а в фибробластах сердца и астроцитах мозга существенно ниже. Кроме того, эффективность NHEJ снижается с возрастом в 1,8—3,8 раз в зависимости от ткани. Снижение эффективности работы NHEJ ведёт к увеличению нерепарированных или плохо репарированных участков ДНК, что существенно способствует старению. Показано, что Ku80 у человека, коровы и мыши экспрессируется на значительно различающихся уровнях, причём этот уровень связан с продолжительностью жизни[44][45].
История изучения
Первые свидетельства того, что белки Ku взаимодействуют с линейными и кольцевыми фрагментами ДНК, содержащими разрыв, были получены в 1980-х—1990-х годах. В 1986 году было показано, что Ku связывают разрывы очень эффективно: 40 фемтомоль Ku связывают 90 % концов ДНК в пробе с концентрацией ДНК 25 фемтомоль. В то же время было продемонстрировано, что кольцевые плазмиды, не содержащие разрывы, с белками Ku не взаимодействуют, однако начинают связывать Ku после обработки эндонуклеазами рестрикции. Впоследствии было показано, что белки Ku быстро связывают концы двуцепочечного разрыва и удерживают их рядом друг с другом, позволяя им далее воссоединиться, то есть восстановить разрыв[46]. В 1996 году для обозначения нового пути репарации двуцепочечных разрывов Дж. К. Мур и Дж. Э. Хабер предложили термин «негомологичное соединение концов»[3].
Примечания
- Кребс, Голдштейн, Килпатрик, 2017, с. 406.
- Прошкина, Юранева, Москалев, 2018, с. 22.
- Moore J. K., Haber J. E. Cell cycle and genetic requirements of two pathways of nonhomologous end-joining repair of double-strand breaks in Saccharomyces cerevisiae. (англ.) // Molecular And Cellular Biology. — 1996. — May (vol. 16, no. 5). — P. 2164—2173. — PMID 8628283.
- Boulton S. J., Jackson S. P. Saccharomyces cerevisiae Ku70 potentiates illegitimate DNA double-strand break repair and serves as a barrier to error-prone DNA repair pathways. (англ.) // The EMBO Journal. — 1996. — 16 September (vol. 15, no. 18). — P. 5093—5103. — PMID 8890183.
- Wilson T. E., Lieber M. R. Efficient processing of DNA ends during yeast nonhomologous end joining. Evidence for a DNA polymerase beta (Pol4)-dependent pathway. (англ.) // The Journal Of Biological Chemistry. — 1999. — 13 August (vol. 274, no. 33). — P. 23599—23609. — PMID 10438542.
- Budman J., Chu G. Processing of DNA for nonhomologous end-joining by cell-free extract. (англ.) // The EMBO Journal. — 2005. — 23 February (vol. 24, no. 4). — P. 849—860. — doi:10.1038/sj.emboj.7600563. — PMID 15692565.
- Espejel S., Franco S., Rodríguez-Perales S., Bouffler S. D., Cigudosa J. C., Blasco M. A. Mammalian Ku86 mediates chromosomal fusions and apoptosis caused by critically short telomeres. (англ.) // The EMBO Journal. — 2002. — 1 May (vol. 21, no. 9). — P. 2207—2219. — doi:10.1093/emboj/21.9.2207. — PMID 11980718.
- Guirouilh-Barbat J., Huck S., Bertrand P., Pirzio L., Desmaze C., Sabatier L., Lopez B. S. Impact of the KU80 pathway on NHEJ-induced genome rearrangements in mammalian cells. (англ.) // Molecular Cell. — 2004. — 4 June (vol. 14, no. 5). — P. 611—623. — doi:10.1016/j.molcel.2004.05.008. — PMID 15175156.
- Weller G. R., Kysela B., Roy R., Tonkin L. M., Scanlan E., Della M., Devine S. K., Day J. P., Wilkinson A., d'Adda di Fagagna F., Devine K. M., Bowater R. P., Jeggo P. A., Jackson S. P., Doherty A. J. Identification of a DNA nonhomologous end-joining complex in bacteria. (англ.) // Science (New York, N.Y.). — 2002. — 6 September (vol. 297, no. 5587). — P. 1686—1689. — doi:10.1126/science.1074584. — PMID 12215643.
- Gong C., Bongiorno P., Martins A., Stephanou N. C., Zhu H., Shuman S., Glickman M. S. Mechanism of nonhomologous end-joining in mycobacteria: a low-fidelity repair system driven by Ku, ligase D and ligase C. (англ.) // Nature Structural & Molecular Biology. — 2005. — April (vol. 12, no. 4). — P. 304—312. — doi:10.1038/nsmb915. — PMID 15778718.
- Della M., Palmbos P. L., Tseng H. M., Tonkin L. M., Daley J. M., Topper L. M., Pitcher R. S., Tomkinson A. E., Wilson T. E., Doherty A. J. Mycobacterial Ku and ligase proteins constitute a two-component NHEJ repair machine. (англ.) // Science (New York, N.Y.). — 2004. — 22 October (vol. 306, no. 5696). — P. 683—685. — doi:10.1126/science.1099824. — PMID 15499016.
- Pitcher R. S., Green A. J., Brzostek A., Korycka-Machala M., Dziadek J., Doherty A. J. NHEJ protects mycobacteria in stationary phase against the harmful effects of desiccation. (англ.) // DNA Repair. — 2007. — 1 September (vol. 6, no. 9). — P. 1271—1276. — doi:10.1016/j.dnarep.2007.02.009. — PMID 17360246.
- Pitcher R. S., Tonkin L. M., Daley J. M., Palmbos P. L., Green A. J., Velting T. L., Brzostek A., Korycka-Machala M., Cresawn S., Dziadek J., Hatfull G. F., Wilson T. E., Doherty A. J. Mycobacteriophage exploit NHEJ to facilitate genome circularization. (англ.) // Molecular Cell. — 2006. — 1 September (vol. 23, no. 5). — P. 743—748. — doi:10.1016/j.molcel.2006.07.009. — PMID 16949369.
- Marshall Craig J., Santangelo Thomas J. Archaeal DNA Repair Mechanisms (англ.) // Biomolecules. — 2020. — 23 October (vol. 10, no. 11). — P. 1472. — ISSN 2218-273X. — doi:10.3390/biom10111472.
- Davis Anthony J., Chen Benjamin P.C., Chen David J. DNA-PK: A dynamic enzyme in a versatile DSB repair pathway (англ.) // DNA Repair. — 2014. — May (vol. 17). — P. 21—29. — ISSN 1568-7864. — doi:10.1016/j.dnarep.2014.02.020.
- McVey M., Lee S. E. MMEJ repair of double-strand breaks (director's cut): deleted sequences and alternative endings. (англ.) // Trends In Genetics : TIG. — 2008. — November (vol. 24, no. 11). — P. 529—538. — doi:10.1016/j.tig.2008.08.007. — PMID 18809224.
- Chen L., Trujillo K., Ramos W., Sung P., Tomkinson A. E. Promotion of Dnl4-catalyzed DNA end-joining by the Rad50/Mre11/Xrs2 and Hdf1/Hdf2 complexes. (англ.) // Molecular Cell. — 2001. — November (vol. 8, no. 5). — P. 1105—1115. — PMID 11741545.
- Zha S., Boboila C., Alt F. W. Mre11: roles in DNA repair beyond homologous recombination. (англ.) // Nature Structural & Molecular Biology. — 2009. — August (vol. 16, no. 8). — P. 798—800. — doi:10.1038/nsmb0809-798. — PMID 19654615.
- Palmbos P. L., Wu D., Daley J. M., Wilson T. E. Recruitment of Saccharomyces cerevisiae Dnl4-Lif1 complex to a double-strand break requires interactions with Yku80 and the Xrs2 FHA domain. (англ.) // Genetics. — 2008. — December (vol. 180, no. 4). — P. 1809—1819. — doi:10.1534/genetics.108.095539. — PMID 18832348.
- Yano K., Morotomi-Yano K., Wang S. Y., Uematsu N., Lee K. J., Asaithamby A., Weterings E., Chen D. J. Ku recruits XLF to DNA double-strand breaks. (англ.) // EMBO Reports. — 2008. — January (vol. 9, no. 1). — P. 91—96. — doi:10.1038/sj.embor.7401137. — PMID 18064046.
- Chirgadze D. Y. et al. DNA-PKcs, allostery, and DNA double-strand break repair: defining the structure and setting the stage (англ.) // Methods in enzymology. — 2017. — Vol. 592. — P. 145—157. — doi:10.1016/bs.mie.2017.04.001.
- DeFazio L. G., Stansel R. M., Griffith J. D., Chu G. Synapsis of DNA ends by DNA-dependent protein kinase. (англ.) // The EMBO Journal. — 2002. — 17 June (vol. 21, no. 12). — P. 3192—3200. — doi:10.1093/emboj/cdf299. — PMID 12065431.
- Nick McElhinny S. A., Ramsden D. A. Sibling rivalry: competition between Pol X family members in V(D)J recombination and general double strand break repair. (англ.) // Immunological Reviews. — 2004. — August (vol. 200). — P. 156—164. — doi:10.1111/j.0105-2896.2004.00160.x. — PMID 15242403.
- Daley J. M., Laan R. L., Suresh A., Wilson T. E. DNA joint dependence of pol X family polymerase action in nonhomologous end joining. (англ.) // The Journal Of Biological Chemistry. — 2005. — 12 August (vol. 280, no. 32). — P. 29030—29037. — doi:10.1074/jbc.M505277200. — PMID 15964833.
- Wilson T. E., Grawunder U., Lieber M. R. Yeast DNA ligase IV mediates non-homologous DNA end joining. (англ.) // Nature. — 1997. — 31 July (vol. 388, no. 6641). — P. 495—498. — doi:10.1038/41365. — PMID 9242411.
- Ahnesorg P., Smith P., Jackson S. P. XLF interacts with the XRCC4-DNA ligase IV complex to promote DNA nonhomologous end-joining. (англ.) // Cell. — 2006. — 27 January (vol. 124, no. 2). — P. 301—313. — doi:10.1016/j.cell.2005.12.031. — PMID 16439205.
- Buck D., Malivert L., de Chasseval R., Barraud A., Fondanèche M. C., Sanal O., Plebani A., Stéphan J. L., Hufnagel M., le Deist F., Fischer A., Durandy A., de Villartay J. P., Revy P. Cernunnos, a novel nonhomologous end-joining factor, is mutated in human immunodeficiency with microcephaly. (англ.) // Cell. — 2006. — 27 January (vol. 124, no. 2). — P. 287—299. — doi:10.1016/j.cell.2005.12.030. — PMID 16439204.
- Callebaut I., Malivert L., Fischer A., Mornon J. P., Revy P., de Villartay J. P. Cernunnos interacts with the XRCC4 x DNA-ligase IV complex and is homologous to the yeast nonhomologous end-joining factor Nej1. (англ.) // The Journal Of Biological Chemistry. — 2006. — 19 May (vol. 281, no. 20). — P. 13857—13860. — doi:10.1074/jbc.C500473200. — PMID 16571728.
- Riballo E., Woodbine L., Stiff T., Walker S. A., Goodarzi A. A., Jeggo P. A. XLF-Cernunnos promotes DNA ligase IV-XRCC4 re-adenylation following ligation. (англ.) // Nucleic Acids Research. — 2009. — February (vol. 37, no. 2). — P. 482—492. — doi:10.1093/nar/gkn957. — PMID 19056826.
- Mimitou E. P., Symington L. S. DNA end resection: many nucleases make light work. (англ.) // DNA repair. — 2009. — Vol. 8, no. 9. — P. 983—995. — doi:10.1016/j.dnarep.2009.04.017. — PMID 19473888.
- Ragu Sandrine, Matos-Rodrigues Gabriel, Thomas Melissa, Lopez Bernard S. Homologous recombination in mammalian cells: From molecular mechanisms to pathology (англ.) // Genome Stability. — 2021. — P. 367—392. — doi:10.1016/B978-0-323-85679-9.00020-9.
- Decottignies A. Alternative end-joining mechanisms: a historical perspective. (англ.) // Frontiers In Genetics. — 2013. — Vol. 4. — P. 48—48. — doi:10.3389/fgene.2013.00048. — PMID 23565119.
- Blokhina Yana P., Buchwalter Abigail. Moving fast and breaking things: Incidence and repair of DNA damage within ribosomal DNA repeats (англ.) // Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. — 2020. — May (vol. 821). — P. 111715. — ISSN 0027-5107. — doi:10.1016/j.mrfmmm.2020.111715.
- Shibata A., Conrad S., Birraux J., Geuting V., Barton O., Ismail A., Kakarougkas A., Meek K., Taucher-Scholz G., Löbrich M., Jeggo P. A. Factors determining DNA double-strand break repair pathway choice in G2 phase. (англ.) // The EMBO Journal. — 2011. — 16 March (vol. 30, no. 6). — P. 1079—1092. — doi:10.1038/emboj.2011.27. — PMID 21317870.
- Jung D., Alt F. W. Unraveling V(D)J recombination; insights into gene regulation. (англ.) // Cell. — 2004. — 23 January (vol. 116, no. 2). — P. 299—311. — PMID 14744439.
- Schatz D. G., Baltimore D. Stable expression of immunoglobulin gene V(D)J recombinase activity by gene transfer into 3T3 fibroblasts. (англ.) // Cell. — 1988. — 8 April (vol. 53, no. 1). — P. 107—115. — PMID 3349523.
- Ma Y., Pannicke U., Schwarz K., Lieber M. R. Hairpin opening and overhang processing by an Artemis/DNA-dependent protein kinase complex in nonhomologous end joining and V(D)J recombination. (англ.) // Cell. — 2002. — 22 March (vol. 108, no. 6). — P. 781—794. — PMID 11955432.
- Gilfillan S., Dierich A., Lemeur M., Benoist C., Mathis D. Mice lacking TdT: mature animals with an immature lymphocyte repertoire. (англ.) // Science (New York, N.Y.). — 1993. — 27 August (vol. 261, no. 5125). — P. 1175—1178. — PMID 8356452.
- Komori T., Okada A., Stewart V., Alt F. W. Lack of N regions in antigen receptor variable region genes of TdT-deficient lymphocytes. (англ.) // Science (New York, N.Y.). — 1993. — 27 August (vol. 261, no. 5125). — P. 1171—1175. — PMID 8356451.
- Boulton S. J., Jackson S. P. Components of the Ku-dependent non-homologous end-joining pathway are involved in telomeric length maintenance and telomeric silencing. (англ.) // The EMBO Journal. — 1998. — 16 March (vol. 17, no. 6). — P. 1819—1828. — doi:10.1093/emboj/17.6.1819. — PMID 9501103.
- Kerzendorfer C., O'Driscoll M. Human DNA damage response and repair deficiency syndromes: linking genomic instability and cell cycle checkpoint proficiency. (англ.) // DNA Repair. — 2009. — 2 September (vol. 8, no. 9). — P. 1139—1152. — doi:10.1016/j.dnarep.2009.04.018. — PMID 19473885.
- Lees D., Lepage P. Will robots ever replace attendants? Exploring the current capabilities and future potential of robots in education and rehabilitation. (англ.) // International Journal Of Rehabilitation Research. Internationale Zeitschrift Fur Rehabilitationsforschung. Revue Internationale De Recherches De Readaptation. — 1994. — December (vol. 17, no. 4). — P. 285—304. — PMID 7875923.
- Vaidya A., Mao Z., Tian X., Spencer B., Seluanov A., Gorbunova V. Knock-in reporter mice demonstrate that DNA repair by non-homologous end joining declines with age. (англ.) // PLoS Genetics. — 2014. — July (vol. 10, no. 7). — P. e1004511—1004511. — doi:10.1371/journal.pgen.1004511. — PMID 25033455.
- Gorbunova V., Seluanov A., Mao Z., Hine C. Changes in DNA repair during aging (англ.) // Nucleic Acids Research. — 2007. — 26 November (vol. 35, no. 22). — P. 7466—7474. — ISSN 0305-1048. — doi:10.1093/nar/gkm756.
- Lorenzini A., Johnson F. B., Oliver A., Tresini M., Smith J. S., Hdeib M., Sell C., Cristofalo V. J., Stamato T. D. Significant correlation of species longevity with DNA double strand break recognition but not with telomere length. (англ.) // Mechanisms Of Ageing And Development. — 2009. — November (vol. 130, no. 11-12). — P. 784—792. — doi:10.1016/j.mad.2009.10.004. — PMID 19896964.
- Yang Kai, Guo Rong, Xu Dongyi. Non-homologous end joining: advances and frontiers (англ.) // Acta Biochimica et Biophysica Sinica. — 2016. — 23 May (vol. 48, no. 7). — P. 632—640. — ISSN 1672-9145. — doi:10.1093/abbs/gmw046.
Литература
- Кребс Дж., Голдштейн Э., Килпатрик С. Гены по Льюину. — М.: Лаборатория знаний, 2017. — 919 с. — ISBN 978-5-906828-24-8.
- Прошкина Е. Н., Юранева И. Н., Москалев А. А. Молекулярная биология: стресс-реакции клетки. — М.: Юрайт, 2018. — 101 с. — ISBN 978-5-534-06471-1.