Надпероксид калия
Надперокси́д ка́лия (диоксид калия, супероксид калия; KO2) — неорганическое соединение жёлтого цвета, которое образуется в результате сгорания расплавленного калия в чистом кислороде. Используется во многих системах жизнеобеспечения. Молекулярный вес 71,10. Температура плавления при нормальном атмосферном давлении 490—530 °C, в вакууме (1—2 мм рт. ст.) 350—415 °C. Гигроскопичен, поглощает из воздуха водяные пары и углекислый газ. Реагирует с водой и этанолом. Плотность 2,158 г/см³.
| Надпероксид калия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Надпероксид калия |
| Традиционные названия | диоксид калия, супероксид калия, гипероксид калия, надперекись калия |
| Хим. формула | KO2 |
| Физические свойства | |
| Молярная масса | 71,10 г/моль |
| Плотность | 2,158 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 535 °C |
| Энтальпия | |
| • образования | −280 кДж/моль |
| Структура | |
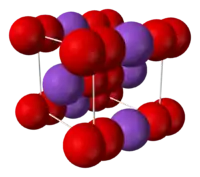
| Кристаллическая структура | Тетрагональная сингония, ячейка типа CaC2 |
| Классификация | |
| Рег. номер CAS | 12030-88-5 |
| PubChem | 61541 |
| Рег. номер EINECS | 234-746-5 |
| SMILES | |
| InChI | |
| RTECS | TT6053000 |
| ChemSpider | 28638468 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Простой способ получения состоит в сгорании калия в чистом кислороде:
При этом продукт загрязнён примесью K2O2.
К экзотическим можно отнести способ окисления кислородом раствора калия в жидком аммиаке при ≈ −50 °C:
при этом состав зависит от температуры проведения реакции — чем она выше, тем большая степень окисления.
Физические свойства
Оранжево-жёлтые кристаллы тетрагональной сингонии, пространственная группа I 4/mmm, параметры ячейки a = 0,570 нм, b = 0,672 нм, Z = 4, упаковка типа CaC2.
Температура плавления 535 °C под избыточным давлением кислорода.
Раньше надпероксиду калия приписывали формулу K2O4, однако рентгенографические исследования структуры показали, что вещество состоит из ионов K+ и O−
2, что соответствует формуле KO2[1].
Химические свойства
Надпероксид калия неустойчив и при нагревании в вакууме отщепляет кислород:
Вода разлагает надпероксид калия с выделением кислорода:
Разбавленные кислоты разлагают надпероксид калия на пероксид водорода и кислород:
С концентрированной серной кислотой выделяется озон:
Надпероксид калия является сильным окислителем:
Наиболее важной, в практическом применении, является реакция с углекислым газом:
Эта реакция используется в изолирующих противогазах для очистки выдыхаемого воздуха.
С помощью краун-эфиров надпероксид калия удалось растворить в органических растворителях и использовать для окисления органических веществ.
Применение
Промышленность
Надпероксид калия используется в химической промышленности как мощный окислитель, а также для удаления следов углекислого газа CO2 и воды H2O.
Космонавтика и системы жизнеобеспечения
Надпероксид калия применяется в российской космонавтике в качестве источника кислорода и поглотителя углекислого газа. В частности он применяется на российских космических кораблях «Союз» и в специальных костюмах для выхода в открытый космос. Используется также в средствах химзащиты для автономной генерации кислорода и во многих системах жизнеобеспечения (например, в аппаратах для глубоководного погружения, шахтных самоспасателях). Килограмм надпероксида калия может поглотить 0,309 кг CO2 с выделением 0,38 кг кислорода.
Подводные лодки
Также применяется в качестве резервного источника кислорода и поглотителя углекислого газа на подлодках и субмаринах (например, на минисубмарине «Приз»).
Биология
В результате реакции надпероксида калия с водой выделяется кислород. Однако промежуточным продуктом этой реакции в воде является супероксидный радикал — начальный компонент клеточного оксидативного стресса, поэтому надпероксид калия может использоваться в качестве неферментативного источника надпероксида (в отличие от ферментативного образования надпероксида, катализируемого, например ксантиноксидазой) для модельного оксидативного стресса.
См. также
Ссылки
Примечания
- Реми Г. Курс неорганической химии. — М.: Изд. иностр. лит., 1963. — 921 с.

