Диоксид-дихлорид хрома
Диокси́д-дихлори́д хро́ма (хло́ристый хроми́л) — жидкость тёмно-красного цвета, дымится во влажном воздухе вследствие гидролиза, растворим в неполярных растворителях (четыреххлористый углерод, дихлорметан, сероуглерод). Сильный окислитель, при контакте воспламеняет фосфор, серу, скипидар и др., используется в органическом синтезе для получения альдегидов окислением метиларенов и терминальных алкенов.
| Диоксид-дихлорид хрома | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Диоксид-дихлорид хрома(VI) | ||
| Традиционные названия | Хлористый хромил | ||
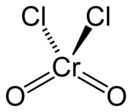
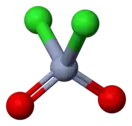
| Хим. формула | CrO2Cl2 | ||
| Физические свойства | |||
| Состояние | кроваво-красная дымящаяся жидкость | ||
| Молярная масса | 154.9008 г/моль | ||
| Плотность | 1.911 г/см³ | ||
| Энергия ионизации | 12,6 ± 0,1 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -96.5 °C | ||
| • кипения | 117 °C | ||
| Давление пара | 20 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | растворяется | ||
| Структура | |||
| Кристаллическая структура | тетраэдральная | ||
| Классификация | |||
| Рег. номер CAS | 14977-61-8 | ||
| PubChem | 22150757 | ||
| Рег. номер EINECS | 239-056-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | GB5775000 | ||
| ChEBI | 33038 | ||
| ChemSpider | 21106426 | ||
| Безопасность | |||
| Пиктограммы СГС |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Синтез
Хромилхлорид впервые был синтезирован Берцелиусом взаимодействием концентрированной серной кислоты со смесью хлорида натрия и бихромата калия с последующей отгонкой продукта:
Он также может быть получен реакцией К2СrО4 (или других хроматов или бихроматов) с концентрированной соляной кислотой (или хлоридами щелочных металлов) и серной кислоты в качестве обезвоживающего агента, CrO2Cl2 в этих случаях отделяется с помощью простой дистилляции, однако, поскольку при нагревании в присутствии серной кислоты хромилхлорид разлагается с образованием сульфата хрома (III) и выделением хлора, выходы в этих методах не превышают 50%. Хлористый хромил может быть получен действием серной кислоты на хлорохромат калия.
Максимальные выходы хлористого хромила получаются при реакции сухого хлороводорода с хромовым ангидридом CrO3 в присутствии серной кислоты на холоду[2].
Свойства
Диоксид-дихлорид хрома является молекулярным соединением. Это означает, что в жидких и твердых агрегатных состояниях молекулы данного соединения будут взаимодействовать исключительно с помощью сил Ван-дер-Ваальса. Такая слабая связь приводит к низким температурам плавления и кипения.
Реакционная способность
Хлористый хромил формально являющийся хлорангидридом хромовой кислоты CrO2Cl2 — сильный электрофил с подвижными атомами хлора, легко замещающимися под действием различных нуклеофилов.
Полный гидролиз ведет к образованию хромовой и соляной кислот:
Гидролиз идет через промежуточное образование хлорхромовой кислоты (формально — монохлорангидрида хромовой кислоты):
- CrO2Cl2 + H2O HOCrO2Cl + HCl ,
избыток хлорид-иона в растворе способствует сдвигу равновесия в сторону хлорхромата: так, гидролиз хромилхлорида в насыщенном водном растворе хлорида калия ведет к образованию хлорохромата калия (соли Пелиго):
- CrO2Cl2 + H2O + KCl KCrO3Cl + 3 HCl
Хлористый хромил в четыреххлористом углероде реагирует с изоцианатом серебра с образованием темно-красного раствора хромилизоцианата:
- CrO2Cl2 + 2 AgOCN CrO2(OCN)2 + 2 AgCl ,
образующийся хромилизоцианат нестабилен и разлагается со взрывом при упаривании раствора при пониженном давлении:
- CrO2(OCN)2 CrO2 + 2 CO + N2
С азотным ангидридом хлористый хромил образует хромилнитрат и нитронилхлорида:
- CrO2Cl2 + 2 N2O5 CrO2(NO3)2 + 2 NO2Cl
Реакция с нитратом хлора также ведет к хромилнитрату[3]:
- CrO2Cl2 + 2 ClNO3 CrO2(NO3)2 + 2 Cl2
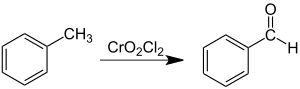
Хромилхлорид с алкилароматическими соединениями образует аддукты (комплексы Этара) в отношении 2:1, дальнейшее разложение этих аддуктов ведет к образованию ароматических альдегидов (реакция Этара):
С алкенами хромилхлорид образует комплексы Этара в отношении 1:1, пути их разложения зависят от строения алкенов, терминальные алкены таким образом могут быть окислены взаимодействием с хромилхлоридом и последующим восстановлением реакционной смеси цинковой пылью до альдегидов с препаративными выходами:
- R1R2C=CH2 R1R2CH-CHO
Опасность применения
Дихлорид-диоксид хрома является очень агрессивным реагентом. Активно реагирует с водой, спиртами и другими сильно электрофильными веществами, такими как VOCl3, TiCl4 и SO2Cl2.
При гидролизе дихлорид-диоксида хрома образуются агрессивные вещества: хлористый водород и соединения шестивалентного хрома (CrVI). CrVI может приводить к хромосомным аберрациям. Частые воздействия на кожу веществом могут привести к её изъязвлениям. Хлористый водород может привести к поражению органов дыхания, вплоть до летального исхода. Воздействие паров диоксида-дихлорида хрома может привести к раздражению дыхательных путей, сильному раздражению глаз и ожогам кожи и глаз. При попадании внутрь может вызвать серьёзные отравления и повреждения внутренних органов.
См. также
Примечания
- http://www.cdc.gov/niosh/npg/npgd0142.html
- Hartford, Winslow H.; Darrin, Marc. The Chemistry Of Chromyl Compounds (англ.) // Chemical Reviews : journal. — 1958. — Vol. 58, no. 1. — P. 1—61. — ISSN 0009-2665. — doi:10.1021/cr50019a001.
- Advances in Inorganic Chemistry and Radiochemistry (англ.). — Academic Press, 1964. — P. 131. — ISBN 978-0-08-057855-2.
Литература
- Реми Г. т.II // Курс неорганической химии. — М.: Мир, 1966. — 836 с.